資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (484 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
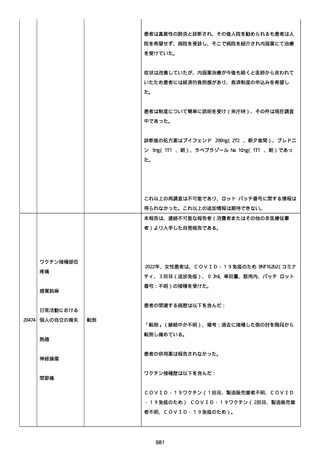
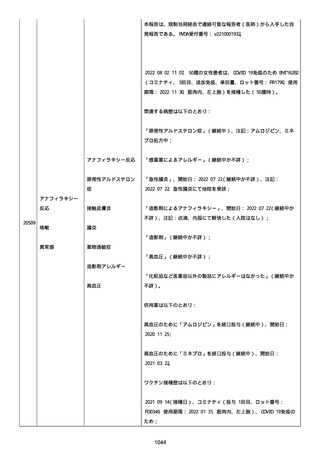
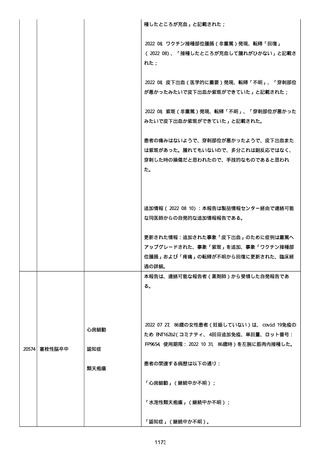
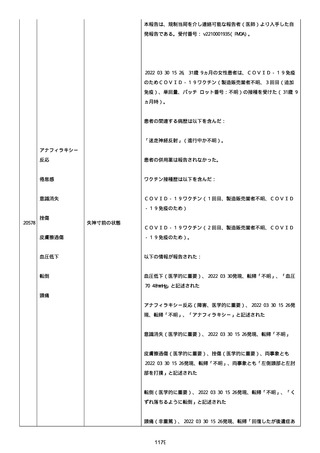
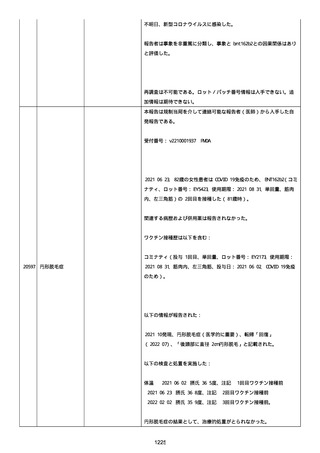
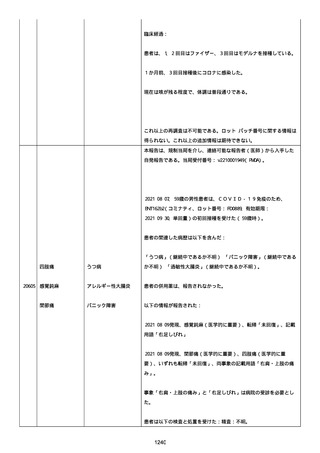
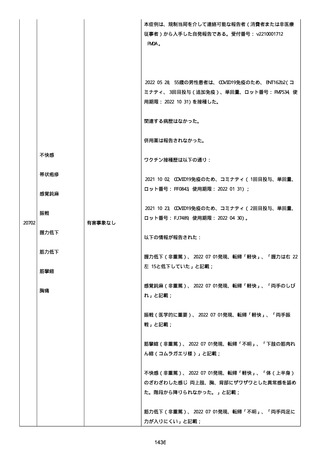
された欠陥がバッチの品質を代表しなく、バッチは許容できると結論
する。
NTM プロセスは、当局通知を必要としないと決定した。報告された欠陥
は確認できなかった。苦情は確認されなかったため、根本的原因また
は是正処置および予防処置は特定されなかった。
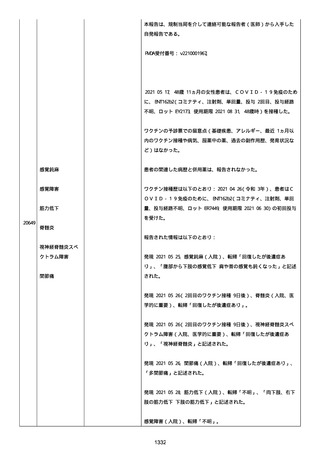
報告者は、「予防接種の効果不良」と「COVID-19」は BNT162b2 と関連
なしと考えた。
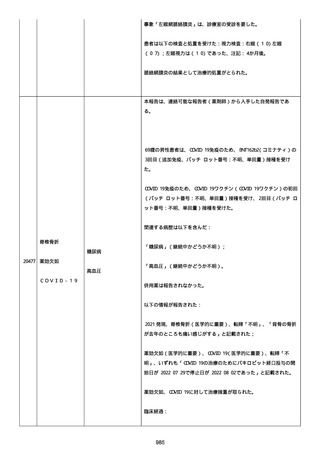
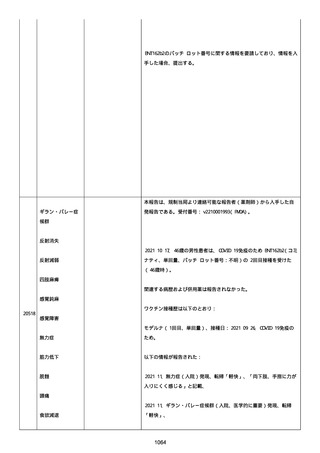
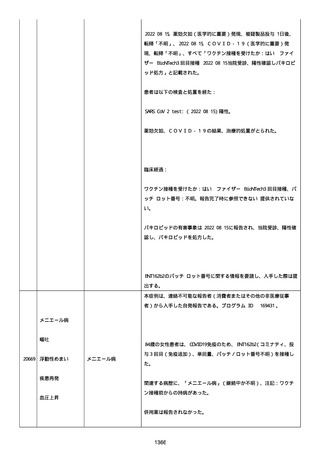
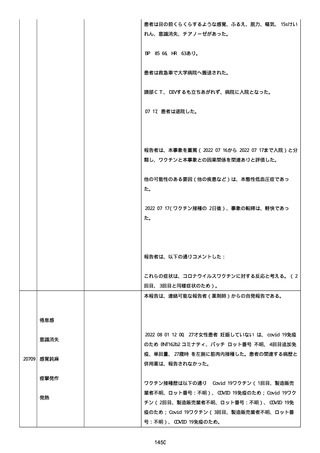
追加情報(2022/07/14):
本報告は、プロトコル C4591006 の非介入試験追加情報報告である。
更新された情報は以下の通り:
障害の重篤性基準、報告者情報、新しい報告者(その他の医療従事
者)、被疑情報(ロット番号、使用期限、投与経路、解剖学的部位、3
回目の投与量)および臨床経過。
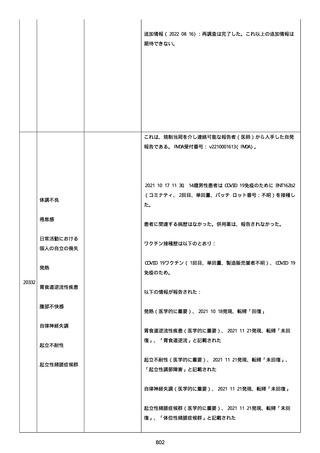
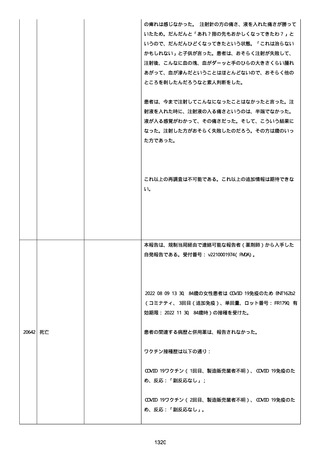
再調査は完了した。これ以上の追加情報は期待できない。
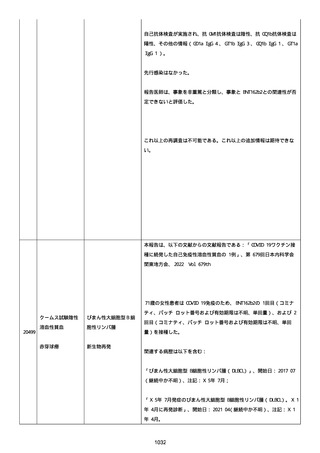
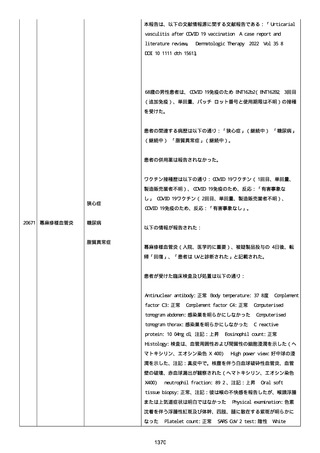
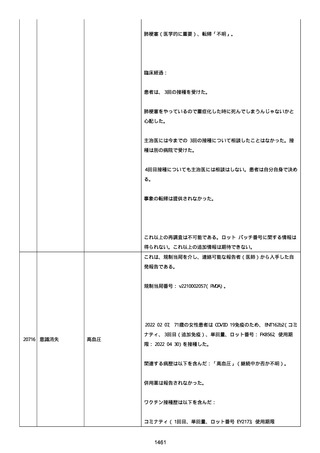
追加報告(2022/07/22):本報告は、製品品質グループから入手した
調査結果の追加報告である。
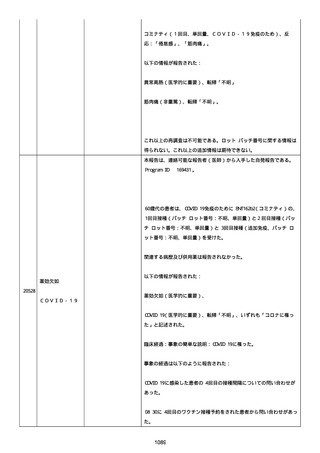
修正:この追加情報は、以前に報告した情報の修正報告である。別の
重篤性基準「障害」が調査担当医師によってすでに報告されたため、
「医学的に重要」の重篤性基準を削除した。
484