資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (1269 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
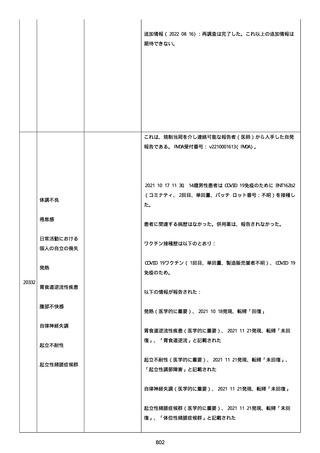
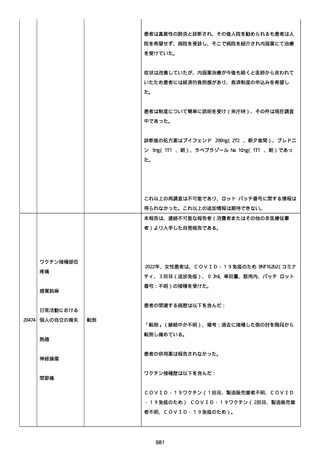
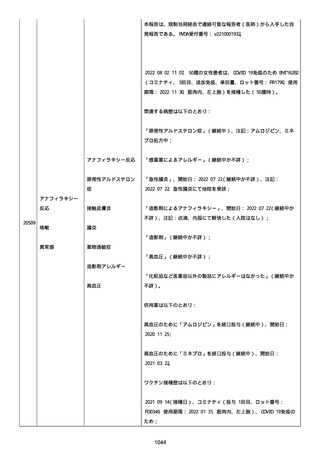
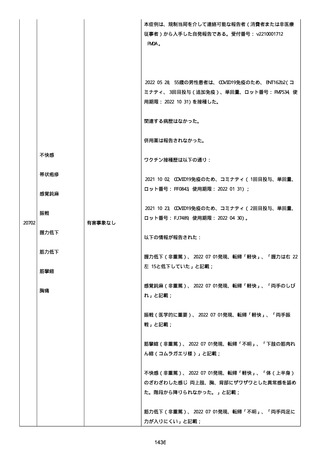
患者は、ファイザーのワクチンを 2 回接種した。
今年(2022 年)の 2 月にコロナに感染した。
そのあと、予防接種を受けるのをためらって、3 回目を接種していな
い。
コロナ感染後の接種が怖い。抗体ができた上に抗体ができるのではな
いかと思い、怖い。
コロナ感染後に接種しても大丈夫か。感染した人は副反応が強くなる
のか。罹患後、何カ月で接種するのか。
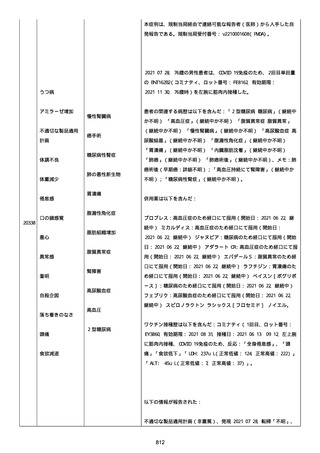
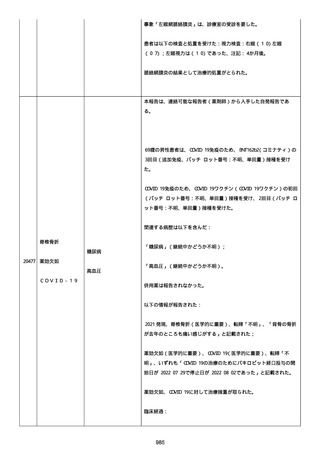
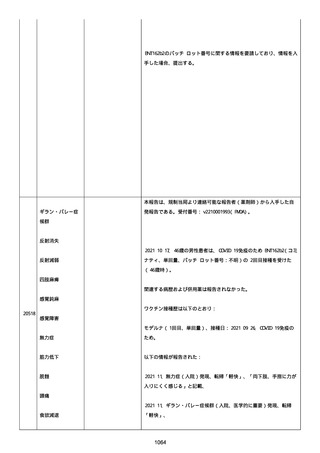
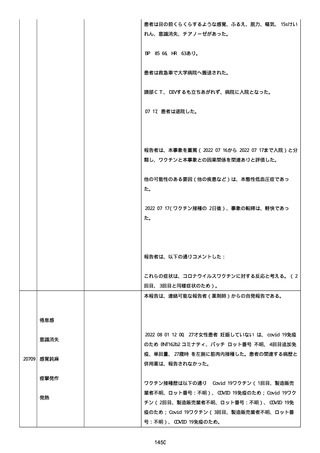
結論:
本ロットに関して、有害事象安全性調査要請および/または薬効欠如に
ついて以前に調査された。当該バッチの出荷後 6 カ月以内に苦情を受
けたため、サンプルは活性成分の量を測定するために品質試験室に送
られなかった。すべての分析的結果はチェックされ、登録された範囲
内であった。
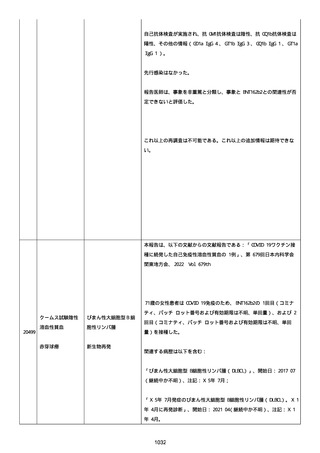
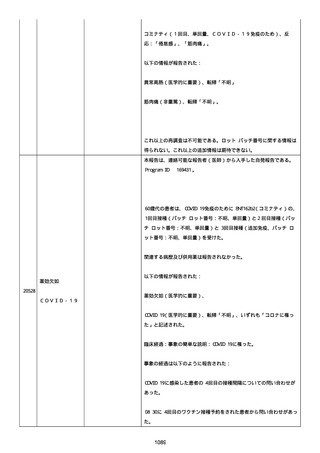
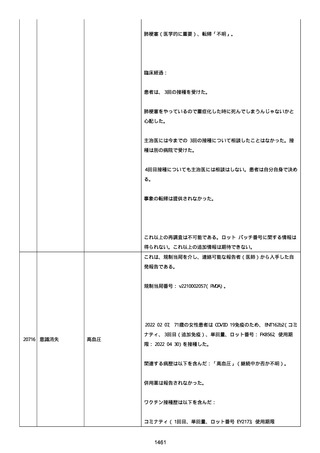
「PFIZER-BIONTECH COVID-19 ワクチン」に対する苦情は調査された。
調査には、関連のあるバッチ記録のレビュー、逸脱調査および報告さ
れたロットと製品タイプについて苦情履歴の分析が含まれた。
最終的な範囲は、報告されたロット FC5295 の関連したロットと決定さ
れた。
NTM プロセスは、規制当局への通知は不要であると判断した。
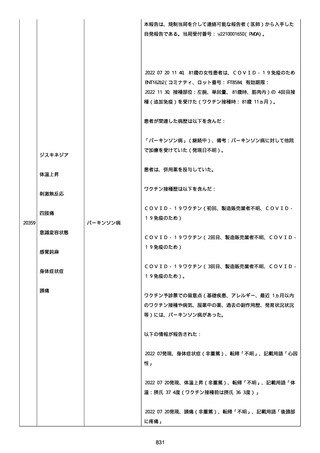
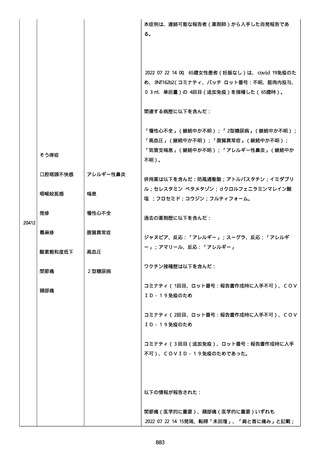
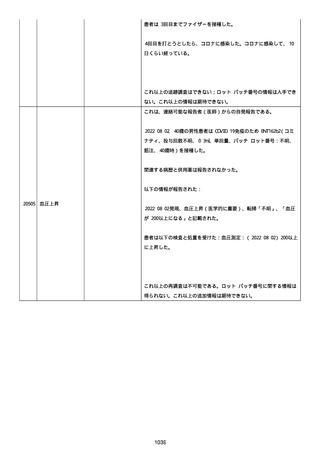
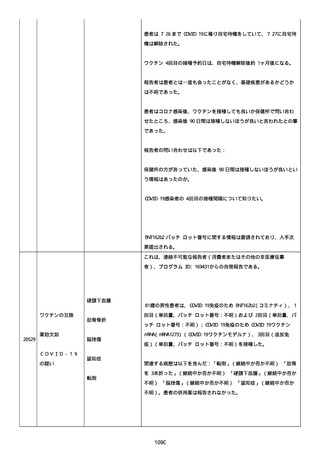
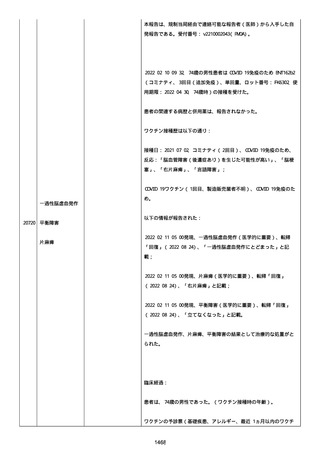
製品品質、規制、バリデーション、安定性への影響はなかった。プー
ルス製造所は報告された欠陥がバッチの品質を代表するものではな
く、バッチは引き続き許容できると結論付ける。
報告された欠陥は確認できなかった。苦情は確認されなかったため、
根本的原因または CAPA は特定されなかった。
1269