資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (1392 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
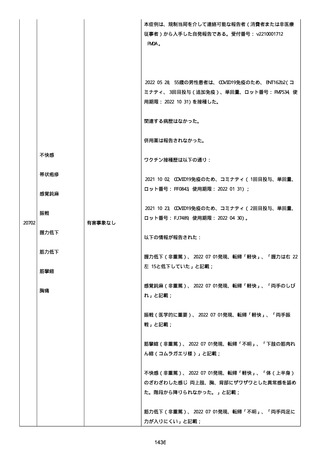
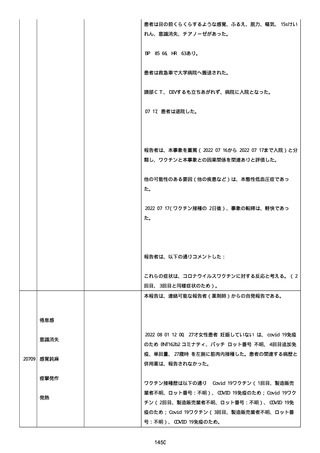
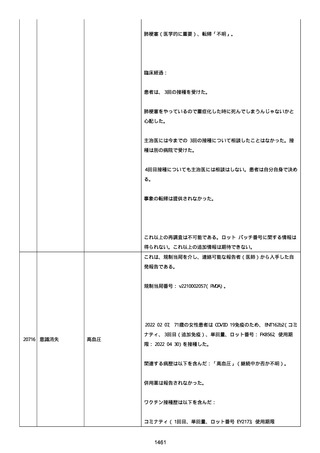
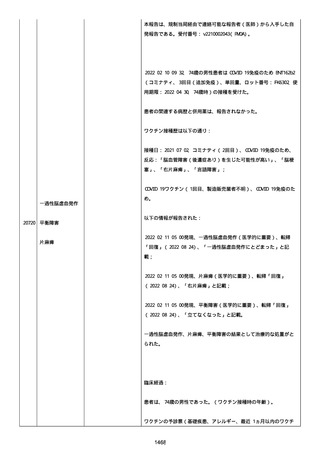
ル。
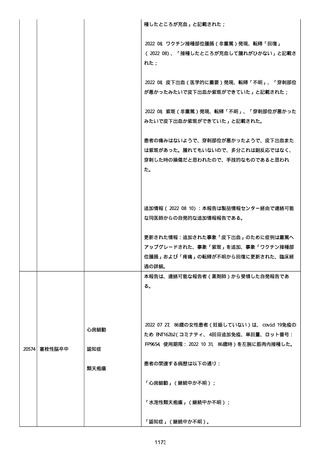
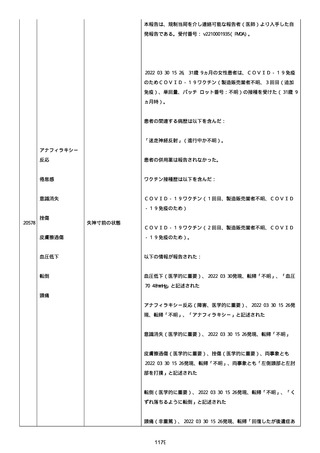
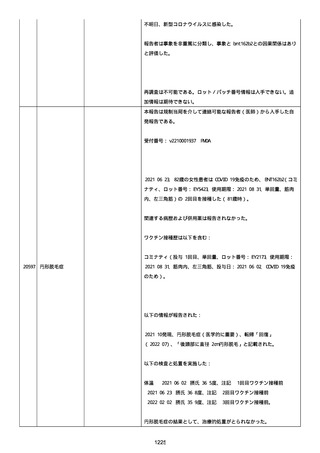
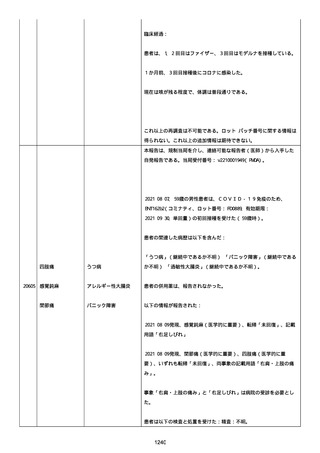
以下の情報が報告された:
2022/08 にすべて発現、薬効欠如(医学的に重要)、COVID-19(医学的
に重要)、転帰「不明」、すべて「COVID-19 治療法としてパキロビッ
ド内服」と記載された。
薬効欠如、COVID-19 の結果として治療的処置がとられた。
臨床経過:パキロビッド、開始日:2022/08/19、終了日:
2022/08/22、ロット番号:FX6462、使用理由:COVID-19 治療、投与経
路:経口。
2 週間以内のその他薬剤の詳細:ベタニス(商標名:アステラス)、ア
ムロジピン OD 5mg(商標名:ニプロ)、バルサルタン 80mg(商標名:
サンド)、ラベプラゾール Na 10mg(商標名:日医工)、カルベジロー
ル 1.25mg(商標名:サワイ)、カロナール 500mg(商標名:あゆ
み)、アルファカルシドール 0.25ug(商標名:アメル)。
結論:本ロットに関して、有害事象安全性調査要請および/または薬効
欠如(LOE)について調査した。すべての分析結果が、予め定められた
範囲内であったことを確認した。参照 PR ID(参照 PR ID 7581058)
の検査の結果は以下の通りであった:
「ファイザー-BIONTECH COVID-19 ワクチン」の有害事象/LOE の苦情を
調査した。調査には、関連のあるバッチ記録、逸脱調査および報告さ
れたロットと製品タイプの苦情履歴の分析が含まれた。最終的範囲
は、報告されたロット番号 FP9654 に関連していると決定された。苦情
サンプルは返却されなかった。関連する品質問題は調査中に特定され
なかった。製品の品質、規制、バリデーション および安定性への影響
はなかった。プールス製造所は、報告された有害事象が、バッチ全体
の品質の典型的なものではなく、バッチは引き続き適合であると結論
した。規制当局への通知は不要と判断した。報告された有害事象内容
は調査により確認することができなかった。有害事象が確認されなか
ったため、根本原因または CAPA も特定されなかった。
1392