法律案新旧対照条文 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
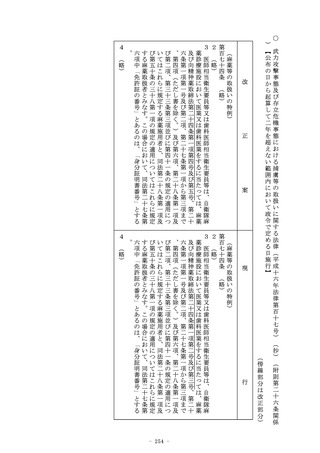
、有効性及び安全性に関する調査(既にこの条又は第十九条の二
の承認(第十四条の二の二の二第一項(第十九条の二第五項にお
いて準用する場合を含む。)の規定により条件及び期限を付した
ものを除く。第十二項において同じ。)を与えられている品目と
の成分、分量、用法、用量、効能、効果等の同一性に関する調査
を含む。)を行うものとする。この場合において、当該品目が第
三項後段に規定する厚生労働省令で定める医薬品であるときは、
あらかじめ、当該品目に係る資料が同項後段の規定に適合するか
どうかについての書面による調査又は実地の調査を行うものとす
る。
6~8 (略)
9 厚生労働大臣は、第一項の承認の申請に係る医薬品が、次の各
号のいずれにも該当するものである場合には、当該医薬品につい
ての第二項第三号の規定による審査又は第六項若しくは前項の規
定による調査を、特に迅速に処理するために、他の医薬品の審査
又は調査(第十一項の規定により優先して行う審査又は調査を含
む。)に優先して行うことができる。
一 既に第一項の承認(第十四条の二の二の二第一項の規定によ
り条件及び期限を付したものを除く。)又は第十九条の二の承
認(同条第五項において準用する第十四条の二の二の二第一項
の規定により条件及び期限を付したものを除く。)を与えられ
ている医薬品(次号において「既承認の医薬品」という。)と
有効成分、分量、用法、用量、効能、効果等が同一性を有する
と認められる医薬品であつて、その用途に関し、外国(医薬品
の品質、有効性及び安全性を確保する上で我が国と同等の水準
にあると認められる医薬品の製造販売の承認の制度又はこれに
相当する制度を有している国として政令で定めるものに限る。
)において、販売し、授与し、又は販売若しくは授与の目的で
貯蔵し、若しくは陳列することが認められている医薬品である
こと。
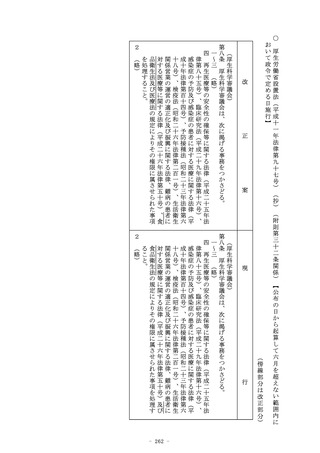
請内容及び第三項前段に規定する資料に基づき、当該品目の品質
、有効性及び安全性に関する調査(既にこの条又は第十九条の二
の承認(第十四条の二の二第一項(第十九条の二第五項において
準用する場合を含む。)の規定により条件及び期限を付したもの
を除く。第十一項において同じ。)を与えられている品目との成
分、分量、用法、用量、効能、効果等の同一性に関する調査を含
む。)を行うものとする。この場合において、当該品目が第三項
後段に規定する厚生労働省令で定める医薬品であるときは、あら
かじめ、当該品目に係る資料が同項後段の規定に適合するかどう
かについての書面による調査又は実地の調査を行うものとする。
7~9 (略)
(新設)
- 6 -