法律案新旧対照条文 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
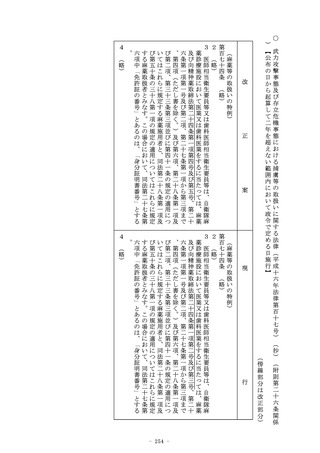
第二十三条の三十二の二 (略)
2~5 (略)
6 第一項の確認を受けた者(その行おうとする変更が第三項の厚
生労働省令で定めるものであるときは、第一項及び第三項の確認
を受けた者に限る。)は、第二十三条の二十五の承認を受けた再
生医療等製品に係る承認された事項の一部について第一項の確認
を受けた変更計画に従つた変更を行う日の厚生労働省令で定める
日数前までに、厚生労働省令で定めるところにより、厚生労働大
(準用)
第二十三条の三十 再生医療等製品(専ら動物のために使用される
ことが目的とされているものを除く。以下この条において同じ。
)のうち政令で定めるものについての前条第一項の申請、同条第
三項の規定による確認及び同条第五項の規定による調査について
は、第二十三条の二十五第十五項及び第二十三条の二十七(第四
項及び第五項を除く。)の規定を準用する。この場合において、
必要な技術的読替えは、政令で定める。
2 (略)
してしなければならない。この場合において、当該申請に係る再
生医療等製品が厚生労働省令で定める再生医療等製品であるとき
は、当該資料は、厚生労働省令で定める基準に従つて収集され、
かつ、作成されたものでなければならない。
5 (略)
6 第一項各号に掲げる再生医療等製品につき第二十三条の二十五
の承認を受けた者は、厚生労働省令で定めるところにより、当該
再生医療等製品の品質、有効性及び安全性に関する調査として厚
生労働省令で定める調査を行い、その結果を厚生労働大臣に報告
しなければならない。
7 (略)
(再生医療等製品の承認された事項に係る変更計画の確認)
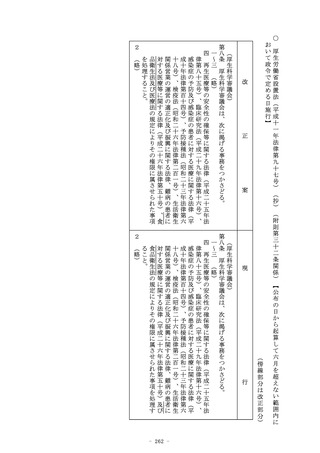
第二十三条の三十二の二 (略)
2~5 (略)
6 第一項の確認を受けた者(その行おうとする変更が第三項の厚
生労働省令で定めるものであるときは、第一項及び第三項の確認
を受けた者に限る。)は、第二十三条の二十五の承認を受けた再
生医療等製品に係る承認された事項の一部について第一項の確認
を受けた変更計画に従つた変更を行う日の厚生労働省令で定める
日数前までに、厚生労働省令で定めるところにより、厚生労働大
(準用)
第二十三条の三十 再生医療等製品(専ら動物のために使用される
ことが目的とされているものを除く。以下この条において同じ。
)のうち政令で定めるものについての前条第一項の申請、同条第
三項の規定による確認及び同条第五項の規定による調査について
は、第二十三条の二十五第十三項及び第二十三条の二十七(第四
項及び第五項を除く。)の規定を準用する。この場合において、
必要な技術的読替えは、政令で定める。
2 (略)
ならない。この場合において、当該申請に係る再生医療等製品が
厚生労働省令で定める再生医療等製品であるときは、当該資料は
、厚生労働省令で定める基準に従つて収集され、かつ、作成され
たものでなければならない。
5 (略)
6 第一項各号に掲げる再生医療等製品につき第二十三条の二十五
の承認を受けた者は、厚生労働省令で定めるところにより、当該
再生医療等製品の使用の成績に関する調査その他厚生労働省令で
定める調査を行い、その結果を厚生労働大臣に報告しなければな
らない。
7 (略)
- 38 -