法律案新旧対照条文 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
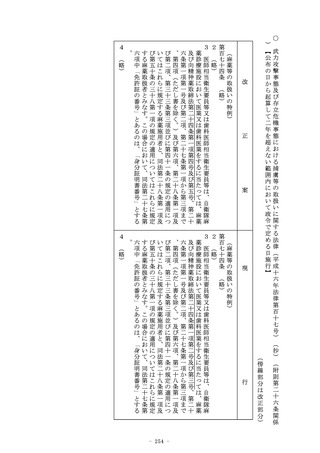
第二十三条の二の八 第二十三条の二の五の承認の申請者が製造販
売をしようとする物が、次の各号のいずれにも該当する医療機器
又は体外診断用医薬品として政令で定めるものである場合には、
厚生労働大臣は、同条第二項、第五項、第六項、第八項及び第十
二項の規定にかかわらず、薬事審議会の意見を聴いて、その品目
に係る同条の承認を与えることができる。
一・二 (略)
2 第二十三条の二の六の三第二項の規定は、前項の規定による第
二十三条の二の五の承認について準用する。
3 (略)
5~7
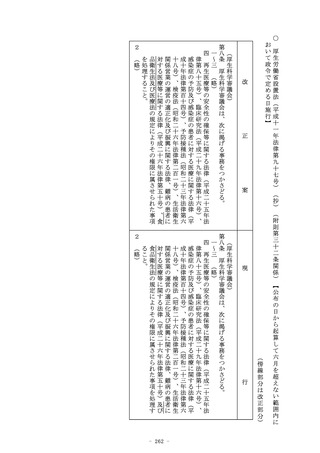
(使用成績評価)
第二十三条の二の九 厚生労働大臣が薬事審議会の意見を聴いて指
定する医療機器又は体外診断用医薬品につき第二十三条の二の五
の承認(第二十三条の二の六の二第一項の規定により条件及び期
限を付したものを除く。第六項において同じ。)を受けた者又は
当該承認を受けている者は、当該医療機器又は体外診断用医薬品
について、厚生労働大臣が指示する期間(次項において「調査期
間」という。)を経過した日から起算して三月以内の期間内に申
請して、厚生労働大臣の使用成績に関する評価を受けなければな
らない。
2・3 (略)
4 第一項の申請は、申請書にその医療機器又は体外診断用医薬品
の使用成績に関する資料その他厚生労働省令で定める資料を添付
してしなければならない。この場合において、当該申請に係る医
療機器又は体外診断用医薬品が厚生労働省令で定める医療機器又
は体外診断用医薬品であるときは、当該資料は、厚生労働省令で
(特例承認)
第二十三条の二の八 第二十三条の二の五の承認の申請者が製造販
売をしようとする物が、次の各号のいずれにも該当する医療機器
又は体外診断用医薬品として政令で定めるものである場合には、
厚生労働大臣は、同条第二項、第六項、第七項、第九項及び第十
一項の規定にかかわらず、薬事審議会の意見を聴いて、その品目
に係る同条の承認を与えることができる。
一・二 (略)
2 第二十三条の二の六の二第二項の規定は、前項の規定による第
二十三条の二の五の承認について準用する。
3 (略)
ばならない。
5~7 (略)
(略)
(使用成績評価)
第二十三条の二の九 厚生労働大臣が薬事審議会の意見を聴いて指
定する医療機器又は体外診断用医薬品につき第二十三条の二の五
の承認(第二十三条の二の六の三第一項の規定により条件及び期
限を付したものを除く。第六項において同じ。)を受けた者又は
当該承認を受けている者は、当該医療機器又は体外診断用医薬品
について、厚生労働大臣が指示する期間(次項において「調査期
間」という。)を経過した日から起算して三月以内の期間内に申
請して、厚生労働大臣の使用成績に関する評価を受けなければな
らない。
2・3 (略)
4 第一項の申請は、申請書にその医療機器又は体外診断用医薬品
の品質、有効性及び安全性に関する資料として厚生労働省令で定
める資料を添付してしなければならない。この場合において、当
該申請に係る医療機器又は体外診断用医薬品が厚生労働省令で定
める医療機器又は体外診断用医薬品であるときは、当該資料は、
- 26 -