法律案新旧対照条文 (109 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
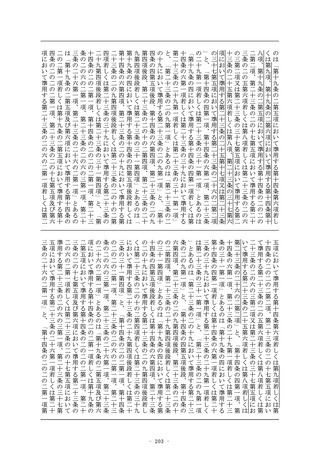
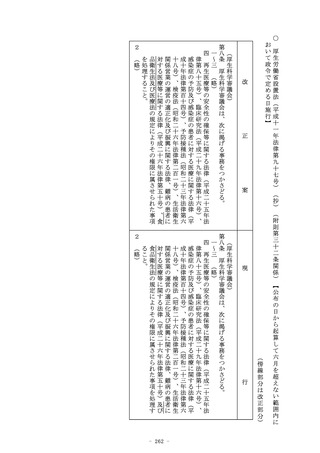
第十九条の二 (略)
2~4 (略)
5 第一項の承認については、第十四条第二項(第一号を除く。)
及び第三項から第十六項まで並びに第十四条の二の二から第十四
条の二の三までの規定を準用する。
6 前項において準用する第十四条第十四項の承認については、同
条第十六項、第十四条の二の二及び第十四条の二の三の規定を準
用する。
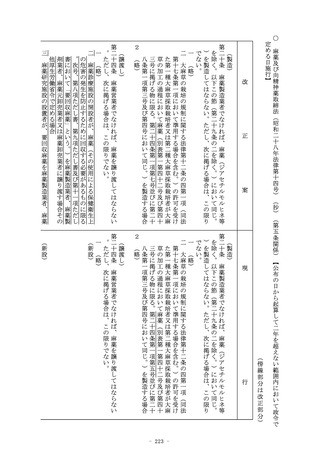
(休廃止等の届出)
第十九条 医薬品、医薬部外品又は化粧品の製造販売業者は、その
事業を廃止し、休止し、若しくは休止した事業を再開したとき、
又は医薬品総括製造販売責任者、医薬品品質保証責任者若しくは
医薬品安全管理責任者若しくは医薬部外品等総括製造販売責任者
その他厚生労働省令で定める事項を変更したときは、三十日以内
に、厚生労働大臣にその旨を届け出なければならない。
2 (略)
(準用)
第十九条の四 外国製造医薬品等特例承認取得者については、第十
四条の四から第十四条の八の二まで及び第十八条第三項の規定を
準用する。
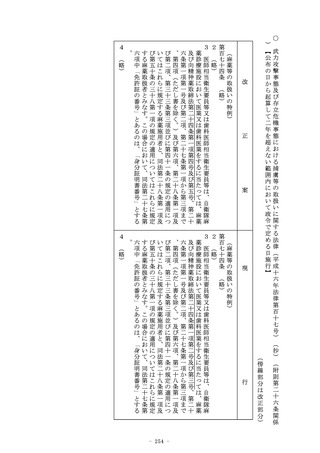
(外国製造医薬品等の製造販売の承認)
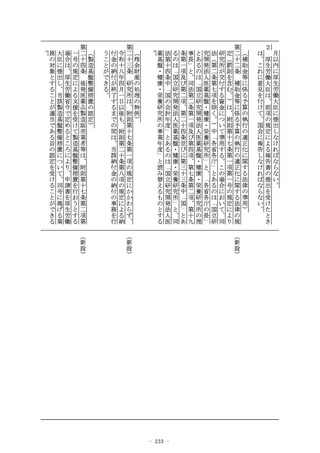
第十九条の二 (略)
2~4 (略)
5 第一項の承認については、第十四条第二項(第一号を除く。)
及び第三項から第十五項まで並びに第十四条の二の二から第十四
条の二の三までの規定を準用する。
6 前項において準用する第十四条第十三項の承認については、同
条第十五項、第十四条の二の二及び第十四条の二の三の規定を準
用する。
2 (略)
製造業者の業務の適正な遂行に必要なものとして厚生労働省令
で定める措置
4 医薬部外品又は化粧品の製造業者は、前項各号に掲げる措置の
内容を記録し、これを適切に保存しなければならない。
(準用)
第十九条の四 外国製造医薬品等特例承認取得者については、第十
四条の四から第十四条の八の二まで、第十八条第五項及び第十八
条の二の六第三項の規定を準用する。
(外国製造医薬品の特例承認)
第二十条 第十九条の二の承認の申請者が選任外国製造医薬品等製
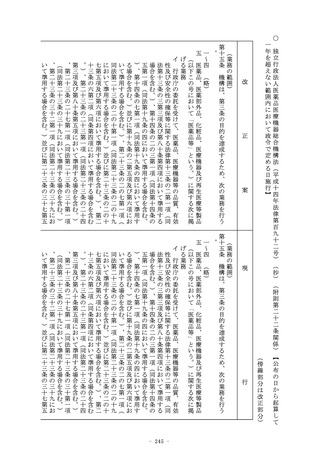
(休廃止等の届出)
第十九条 医薬品、医薬部外品又は化粧品の製造販売業者は、その
事業を廃止し、休止し、若しくは休止した事業を再開したとき、
又は医薬品等総括製造販売責任者その他厚生労働省令で定める事
項を変更したときは、三十日以内に、厚生労働大臣にその旨を届
け出なければならない。
(外国製造医薬品の特例承認)
第二十条 第十九条の二の承認の申請者が選任外国製造医薬品等製
- 107 -