法律案新旧対照条文 (111 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
二の五の承認のための審査、同条第五項、第六項及び第八項(こ
れらの規定を同条第十三項において準用する場合を含む。)、第
二十三条の二の六の二第三項、前条第二項(次条第二項において
準用する場合を含む。)並びに第二十三条の二の十の四第八項の
規定による調査並びに第二十三条の二の六第一項の規定による基
準適合証の交付及び同条第三項の規定による基準適合証の返還の
受付(以下「医療機器等審査等」という。)を行わせることがで
きる。
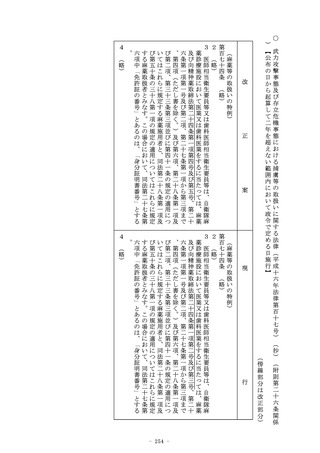
2~7 (略)
(使用成績評価)
第二十三条の二の九 厚生労働大臣が薬事審議会の意見を聴いて指
定する医療機器又は体外診断用医薬品につき第二十三条の二の五
の承認(第二十三条の二の六の三第一項の規定により条件及び期
限を付したものを除く。第六項において同じ。)を受けた者又は
当該承認を受けている者は、当該医療機器又は体外診断用医薬品
について、厚生労働大臣が指示する期間(次項において「調査期
間」という。)を経過した日から起算して三月以内の期間内に申
請して、厚生労働大臣の使用成績に関する評価を受けなければな
らない。
2~7 (略)
おいて同じ。)のうち政令で定めるものについての第二十三条の
二の五の承認のための審査、同条第五項、第六項及び第八項(こ
れらの規定を同条第十三項において準用する場合を含む。)、第
二十三条の二の六の二第三項、前条第二項(次条第二項において
準用する場合を含む。)並びに第二十三条の二の十の二第八項の
規定による調査並びに第二十三条の二の六第一項の規定による基
準適合証の交付及び同条第三項の規定による基準適合証の返還の
受付(以下「医療機器等審査等」という。)を行わせることがで
きる。
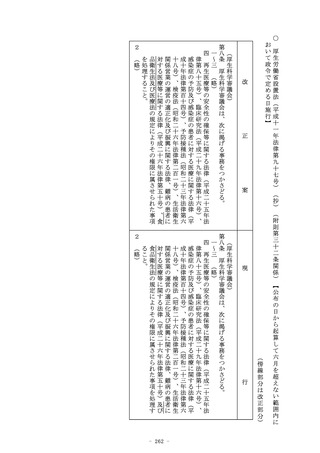
2~7 (略)
(新設)
(使用成績評価)
第二十三条の二の九 厚生労働大臣が薬事審議会の意見を聴いて指
定する医療機器又は体外診断用医薬品につき第二十三条の二の五
の承認(第二十三条の二の六の三第一項の規定により条件及び期
限を付したものを除く。第六項並びに第二十三条の二の十の二第
一項及び第七項において同じ。)を受けた者又は当該承認を受け
ている者は、当該医療機器又は体外診断用医薬品について、厚生
労働大臣が指示する期間(次項において「調査期間」という。)
を経過した日から起算して三月以内の期間内に申請して、厚生労
働大臣の使用成績に関する評価を受けなければならない。
2~7 (略)
(体外診断用医薬品の性能等再評価)
第二十三条の二の十の二 第二十三条の二の五の承認を受けている
者は、厚生労働大臣が薬事審議会の意見を聴いて体外診断用医薬
品の範囲を指定して性能等再評価(体外診断用医薬品について、
同条の承認の取得後に当該承認に係る性能その他の厚生労働省令
で定める事項(第七項において「性能等」という。)を再評価す
ることをいう。以下同じ。)を受けるべき旨を公示したときは、
その指定に係る体外診断用医薬品について、厚生労働大臣の性能
- 109 -