法律案新旧対照条文 (260 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
案
行
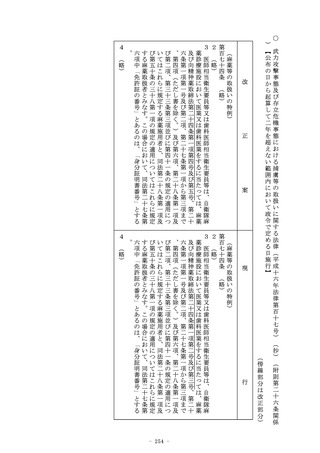
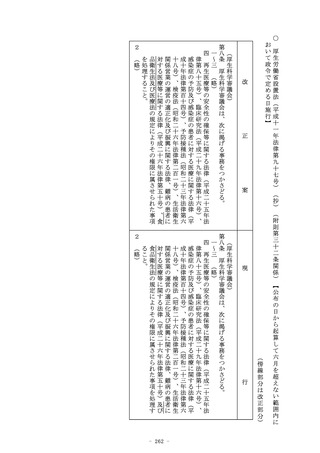
(定義)
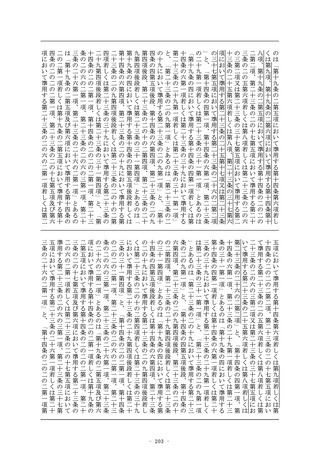
第二条 (略)
2 この法律において「特定臨床研究」とは、臨床研究のうち、次
のいずれかに該当するものをいう。
一 (略)
二 次に掲げる医薬品等を用いる臨床研究(前号に該当するもの
を除く。)
イ (略)
ロ 次項第一号に掲げる医薬品であって、医薬品医療機器等法
第十四条第一項又は第十九条の二第一項の承認(医薬品医療
機器等法第十四条第十五項(医薬品医療機器等法第十九条の
二第五項において準用する場合を含む。)の変更の承認を含
む。以下ロにおいて同じ。)を受けているもの(当該承認に
係る用法、用量、効能及び効果(以下ロにおいて「用法等」
という。)と異なる用法等(人の生命及び健康に影響を与え
るおそれが当該承認に係る用法等と同程度以下のものとして
厚生労働省令で定める用法等を除く。)で用いる場合に限る
。)
ハ (略)
ニ 次項第二号に掲げる医療機器であって、医薬品医療機器等
法第二十三条の二の五第一項若しくは第二十三条の二の十七
第一項の承認(医薬品医療機器等法第二十三条の二の五第十
五項(医薬品医療機器等法第二十三条の二の十七第五項にお
いて準用する場合を含む。)の変更の承認を含む。以下ニに
おいて同じ。)若しくは医薬品医療機器等法第二十三条の二
現
○ 臨床研究法(平成二十九年法律第十六号)(抄)(附則第二十九条関係)【公布の日から起算して一年を超えない範囲内において
政令で定める日施行】
(傍線部分は改正部分)
改
(定義)
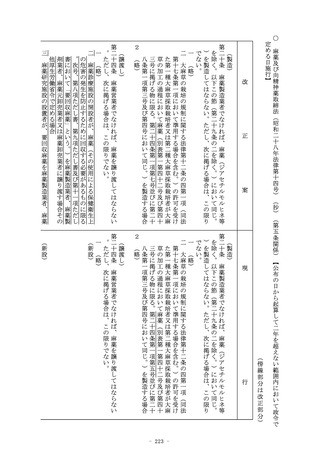
第二条 (略)
2 この法律において「特定臨床研究」とは、臨床研究のうち、次
のいずれかに該当するものをいう。
一 (略)
二 次に掲げる医薬品等を用いる臨床研究(前号に該当するもの
を除く。)
イ (略)
ロ 次項第一号に掲げる医薬品であって、医薬品医療機器等法
第十四条第一項又は第十九条の二第一項の承認(医薬品医療
機器等法第十四条第十三項(医薬品医療機器等法第十九条の
二第五項において準用する場合を含む。)の変更の承認を含
む。以下ロにおいて同じ。)を受けているもの(当該承認に
係る用法、用量、効能及び効果(以下ロにおいて「用法等」
という。)と異なる用法等(人の生命及び健康に影響を与え
るおそれが当該承認に係る用法等と同程度以下のものとして
厚生労働省令で定める用法等を除く。)で用いる場合に限る
。)
ハ (略)
ニ 次項第二号に掲げる医療機器であって、医薬品医療機器等
法第二十三条の二の五第一項若しくは第二十三条の二の十七
第一項の承認(医薬品医療機器等法第二十三条の二の五第十
三項(医薬品医療機器等法第二十三条の二の十七第五項にお
いて準用する場合を含む。)の変更の承認を含む。以下ニに
おいて同じ。)若しくは医薬品医療機器等法第二十三条の二
- 258 -