法律案新旧対照条文 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
十九条の二の承認」と、同条第三項中「第一項の規定により第十
四条の承認を受けた者」とあるのは「第二十条第一項において準
用する第十四条の三第一項の規定により第十九条の二の承認を受
けた者又は選任外国製造医薬品等製造販売業者」と読み替えるも
のとする。
2 (略)
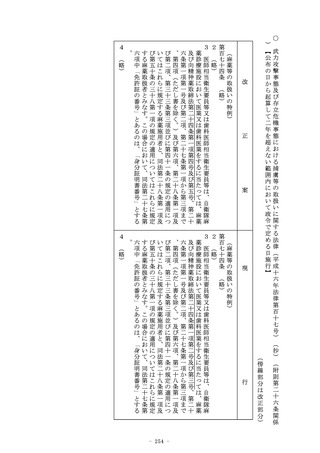
(医療機器及び体外診断用医薬品の製造販売の承認)
第二十三条の二の五 (略)
2 (略)
3 第一項の承認を受けようとする者は、厚生労働省令で定めると
ころにより、申請書に当該申請に係る医療機器又は体外診断用医
薬品の品質、有効性及び安全性に関する資料として厚生労働省令
で定める資料を添付して申請しなければならない。この場合にお
いて、当該申請に係る医療機器又は体外診断用医薬品が厚生労働
省令で定める医療機器又は体外診断用医薬品であるときは、当該
資料は、厚生労働省令で定める基準に従つて収集され、かつ、作
成されたものでなければならない。
4 (略)
(削る)
5~8 (略)
二の二第二項」と、「第十四条の承認」とあるのは「第十九条の
二の承認」と、同条第三項中「第一項の規定により第十四条の承
認を受けた者」とあるのは「第二十条第一項において準用する第
十四条の三第一項の規定により第十九条の二の承認を受けた者又
は選任外国製造医薬品等製造販売業者」と読み替えるものとする
。
2 (略)
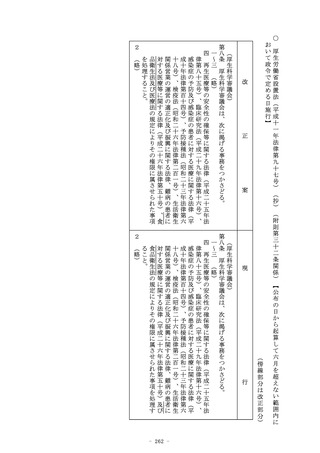
(医療機器及び体外診断用医薬品の製造販売の承認)
第二十三条の二の五 (略)
2 (略)
3 第一項の承認を受けようとする者は、厚生労働省令で定めると
ころにより、申請書に臨床試験の試験成績に関する資料その他の
資料を添付して申請しなければならない。この場合において、当
該申請に係る医療機器又は体外診断用医薬品が厚生労働省令で定
める医療機器又は体外診断用医薬品であるときは、当該資料は、
厚生労働省令で定める基準に従つて収集され、かつ、作成された
ものでなければならない。
4 (略)
5 厚生労働大臣は、第一項の承認の申請に係る医療機器又は体外
診断用医薬品が、希少疾病用医療機器若しくは希少疾病用医薬品
、先駆的医療機器若しくは先駆的医薬品又は特定用途医療機器若
しくは特定用途医薬品その他の医療上特にその必要性が高いと認
められるものである場合であつて、当該医療機器又は体外診断用
医薬品の有効性及び安全性を検証するための十分な人数を対象と
する臨床試験の実施が困難であるときその他の厚生労働省令で定
めるときは、厚生労働省令で定めるところにより、第三項の規定
により添付するものとされた臨床試験の試験成績に関する資料の
一部の添付を要しないこととすることができる。
6~9 (略)
- 18 -