法律案新旧対照条文 (232 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
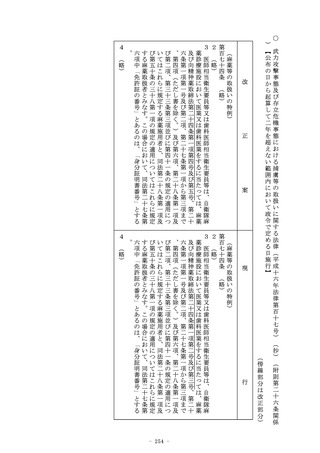
四条第三項において同じ。)の製造(他に委託して行う場合及
び他から委託を受けて行う場合を含む。以下この号において同
じ。)を行う者(以下「後発医薬品製造販売業者等」という。
)であって、自らが製造を行う品目の製造の工程と他の後発医
薬品製造販売業者等が製造を行う品目の製造の工程の統合その
他の後発医薬品の安定的な供給の確保のための製造の基盤の整
備に関する措置であって厚生労働省令で定めるもの(以下「製
造基盤整備措置」という。)を行うものに対し、当該製造基盤
整備措置に必要な資金の交付その他の支援を行うこと。
二 前号に掲げる業務に附帯する業務を行うこと。
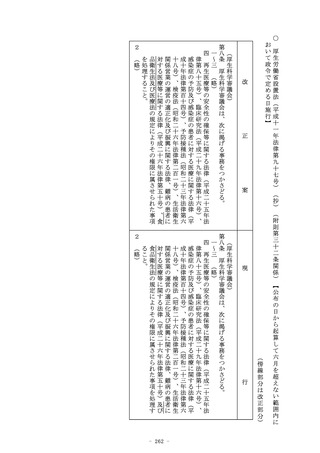
3 前二項の規定による支援は、次条第一項又は附則第二十四条第
一項の認定を受けた者について行うものとする。
4 第一項及び第二項の業務に関する事項については、研究所に係
る通則法における主務大臣は、厚生労働大臣とする。
5 第一項及び第二項の業務は、第二十四条第一号の規定の適用に
ついては、第十五条に規定する業務とみなす。
(事業の認定)
第十八条 革新的医薬品等実用化支援事業者は、前条第一項第一号
の規定による支援を受けて同号に規定する事業を行おうとする場
合は、厚生労働省令で定めるところにより、申請書を厚生労働大
臣に提出し、当該事業について、同号に掲げる業務の対象とする
ことが適当である旨の認定を受けることができる。
2 二以上の革新的医薬品等実用化支援事業者がその事業を共同し
て行おうとする場合にあっては、当該二以上の革新的医薬品等実
用化支援事業者は共同して前項の申請書を作成し、同項の認定を
受けることができる。
3 厚生労働大臣は、第一項の認定の申請があった場合において、
当該申請に係る事業が通則法第三十五条の四第一項に規定する中
長期目標において定める前条第一項第一号に掲げる業務の対象と
(新設)
- 230 -