法律案新旧対照条文 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/topics/bukyoku/soumu/houritu/217.html |
| 出典情報 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案 成立(5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
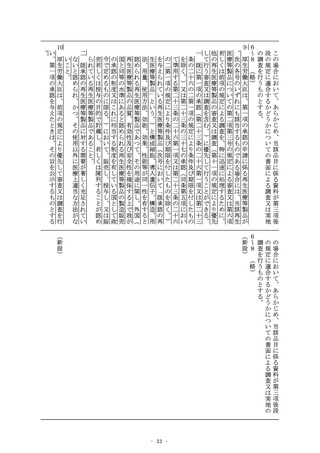
の十一までにおいて同じ。)に記録されているときは、当該電磁
的記録に記録された事項を厚生労働省令で定める方法により表示
したものを含む。)を用いて必要な情報を提供させ、及び必要な
薬学的知見に基づく指導を行わせなければならない。
2~6 (略)
(医薬品、医薬部外品及び化粧品の製造販売の承認)
第十四条 (略)
2 (略)
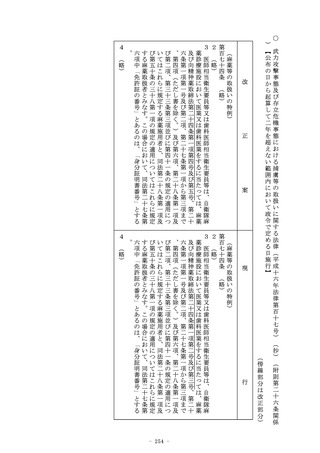
3 第一項の承認を受けようとする者は、厚生労働省令で定めると
ころにより、申請書に当該申請に係る医薬品、医薬部外品又は化
粧品の品質、有効性及び安全性に関する資料として厚生労働省令
で定める資料を添付して申請しなければならない。この場合にお
いて、当該申請に係る医薬品が厚生労働省令で定める医薬品であ
るときは、当該資料は、厚生労働省令で定める基準に従つて収集
され、かつ、作成されたものでなければならない。
4 (略)
(削る)
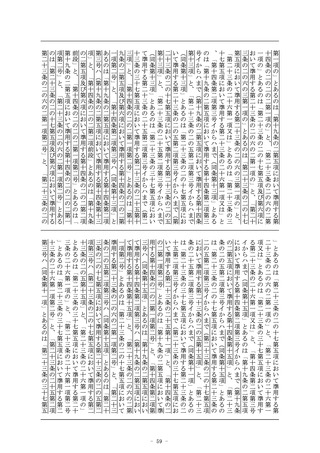
5 第二項第三号の規定による審査においては、当該品目に係る申
省令で定めるものを含む。)により、厚生労働省令で定める事項
を記載した書面(当該事項が電磁的記録(電子的方式、磁気的方
式その他人の知覚によつては認識することができない方式で作ら
れる記録であつて、電子計算機による情報処理の用に供されるも
のをいう。以下第三十六条の十までにおいて同じ。)に記録され
ているときは、当該電磁的記録に記録された事項を厚生労働省令
で定める方法により表示したものを含む。)を用いて必要な情報
を提供させ、及び必要な薬学的知見に基づく指導を行わせなけれ
ばならない。
2~6 (略)
(医薬品、医薬部外品及び化粧品の製造販売の承認)
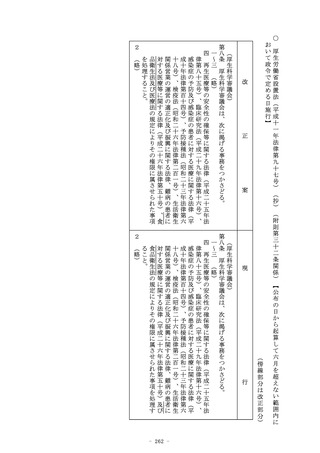
第十四条 (略)
2 (略)
3 第一項の承認を受けようとする者は、厚生労働省令で定めると
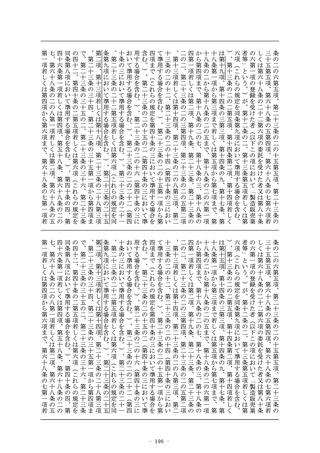
ころにより、申請書に臨床試験の試験成績に関する資料その他の
資料を添付して申請しなければならない。この場合において、当
該申請に係る医薬品が厚生労働省令で定める医薬品であるときは
、当該資料は、厚生労働省令で定める基準に従つて収集され、か
つ、作成されたものでなければならない。
4 (略)
5 厚生労働大臣は、第一項の承認の申請に係る医薬品が、希少疾
病用医薬品、先駆的医薬品又は特定用途医薬品その他の医療上特
にその必要性が高いと認められるものである場合であつて、当該
医薬品の有効性及び安全性を検証するための十分な人数を対象と
する臨床試験の実施が困難であるときその他の厚生労働省令で定
めるときは、厚生労働省令で定めるところにより、第三項の規定
により添付するものとされた臨床試験の試験成績に関する資料の
一部の添付を要しないこととすることができる。
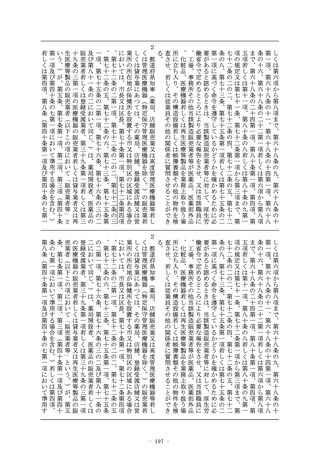
6 第二項第三号の規定による審査においては、当該品目に係る申
- 5 -