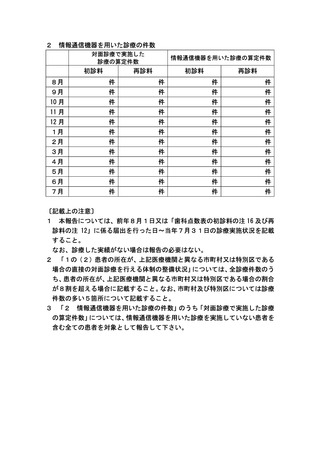
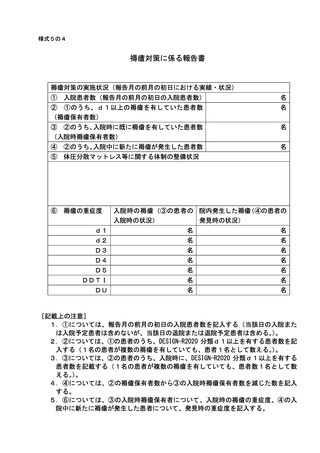
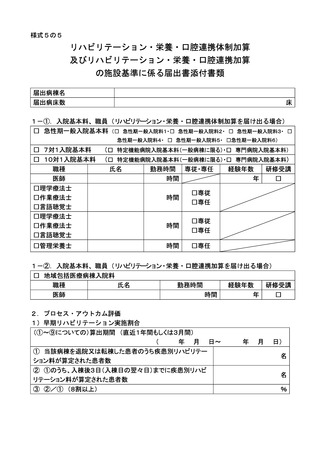
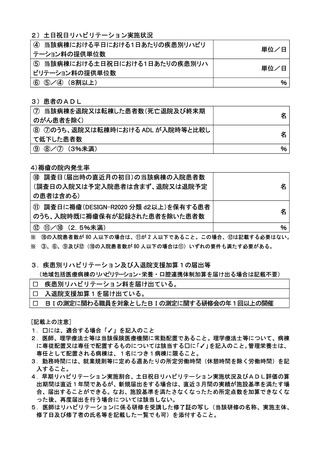
基本診療料の施設基準等及びその届出に関する手続きの取扱いについて(通知) (140 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/content/12404000/001219514.pdf |
| 出典情報 | 基本診療料の施設基準等及びその届出に関する手続きの取扱いについて(3/5付 通知)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
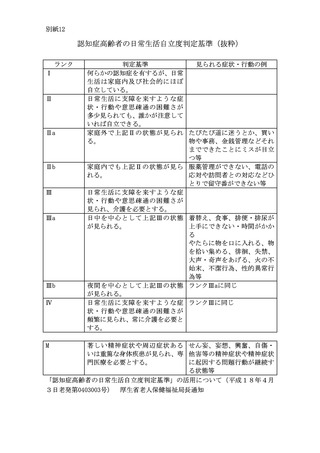
ること。
(2)
直近1年間におけるバイオ後続品のある先発バイオ医薬品先発バイオ医薬品(バイオ後続
品の適応のない患者に対して使用する先発バイオ医薬品は除く。以下「先発バイオ医薬品」
という。)及びバイオ後続品の使用回数の合計が 100 回を超えること。
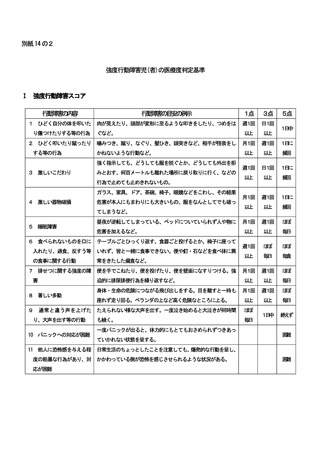
(3)
当該保険医療機関において調剤した先発バイオ医薬品及びバイオ後続品について、当該薬
剤を合算した規格単位数量に占めるバイオ後続品の規格単位数量の割合について、ア及びイ
を満たすこと。
ア
次に掲げる成分について、当該保険医療機関において調剤した先発バイオ医薬品及びバ
イオ後続品について、当該成分全体の規格単位数量に占めるバイオ後続品の規格単位数量
の割合が 80%以上であること。ただし、直近1年間における当該成分の規格単位数量の合
計が 50 未満の場合を除く。
エポエチン
(ロ)
リツキシマブ
(ハ)
トラスツズマブ
(ニ)
テリパラチド
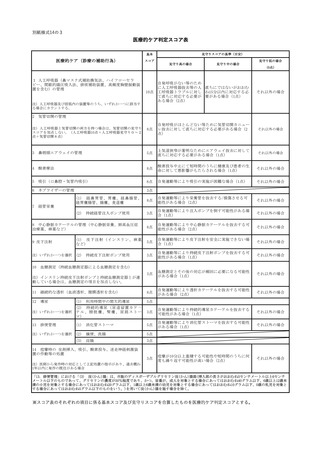
イ
(イ)
次に掲げる成分について、当該保険医療機関において調剤した先発バイオ医薬品及びバ
イオ後続品について、当該成分全体の規格単位数量に占めるバイオ後続品の規格単位数量
の割合が 50%以上であること。ただし、直近1年間における当該成分の規格単位数量の合
計が 50 未満の場合を除く。
(4)
(イ)
ソマトロピン
(ロ)
インフリキシマブ
(ハ)
エタネルセプト
(ニ)
アガルシダーゼベータ
(ホ)
ベバシズマブ
(ヘ)
インスリンリスプロ
(ト)
インスリンアスパルト
(チ)
アダリムマブ
(リ)
ラニビズマブ
入院及び外来においてバイオ後続品の使用に積極的に取り組んでいる旨を当該保険医療機
関の見やすい場所に掲示していること。
(5)
(4)の掲示事項について、原則として、ウェブサイトに掲載していること。自ら管理す
るホームページ等を有しない場合については、この限りではないこと。
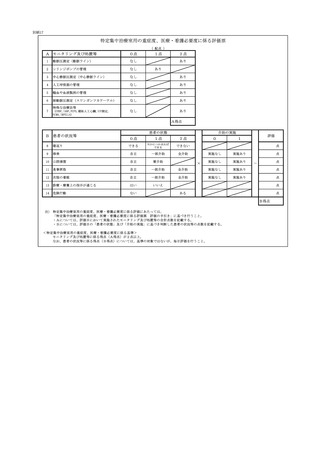
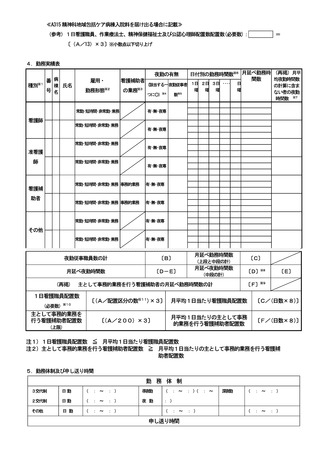
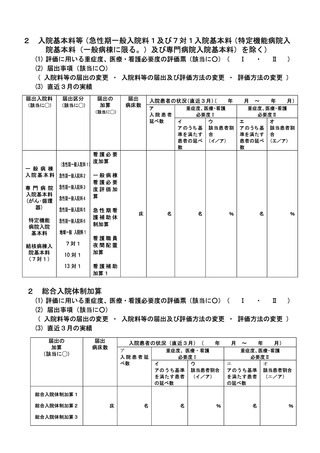
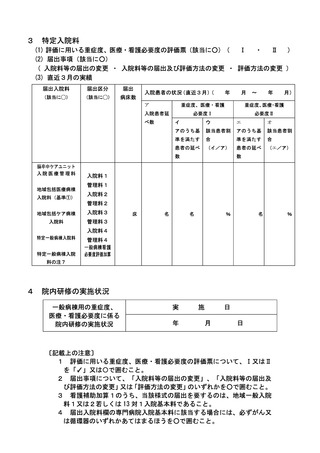
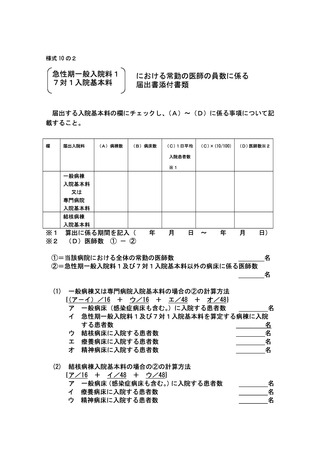
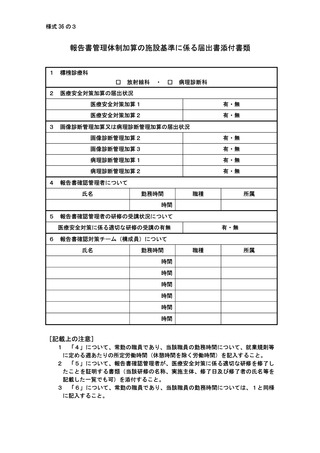
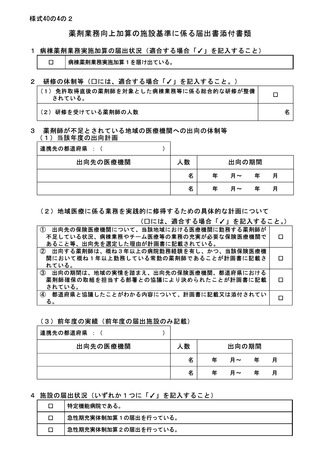
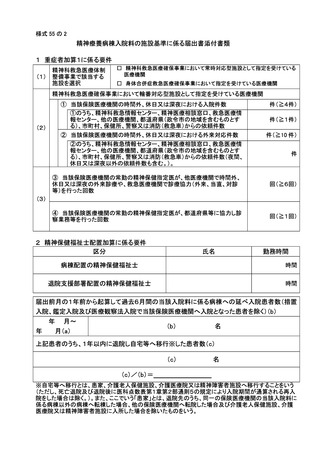
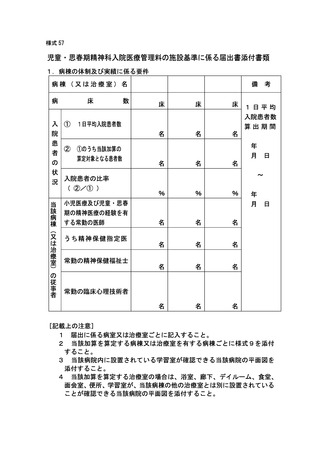
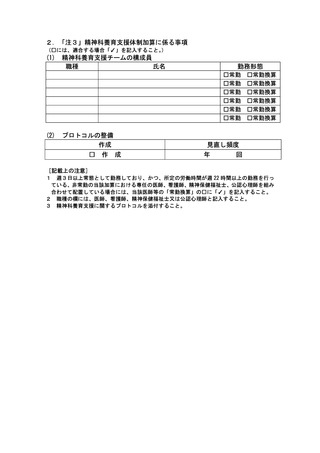
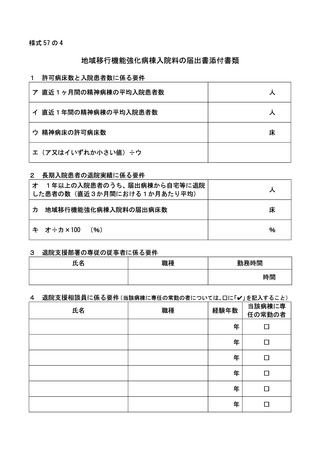
2 届出に関する事項
(1)
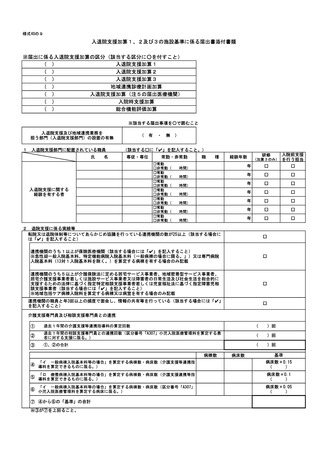
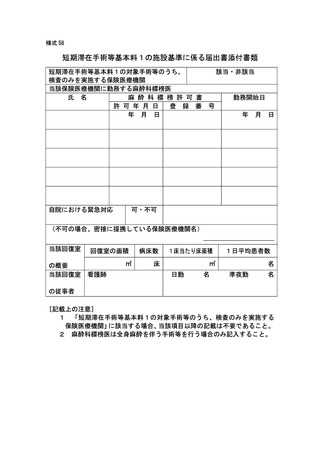
バイオ後続品使用体制加算の施設基準に係る届出は、別添7の様式 40 の3の2を用いるこ
と。
(2)
1の(5)については、令和7年5月 31 日までの間に限り、当該基準を満たしているものと
みなす。
- 140 -