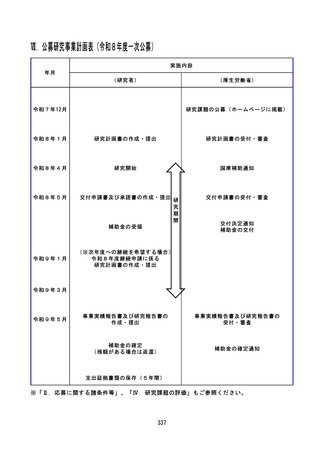
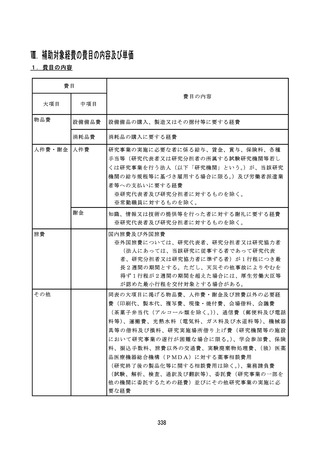
【資料1-3】令和8年度 厚生労働科学研究費補助金公募要項(一次)(案) (308 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67012.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第146回 12/11)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
医薬品・医療機器等レギュラトリーサイエンス政策研究事業
研究事業の概要
(1)背景
薬事行政においては、最先端の技術を活用した医薬品・医療機器・再生医療等製品等の実用
化に向けた承認審査、品質管理、市販後安全対策や、無承認無許可医薬品等の監視業務、麻薬
・覚醒剤等の薬物乱用対策、血液行政、医薬品販売制度に関する課題等に取り組んでいる。
昨今の薬事行政を取り巻く状況の変化を受け、令和元年、令和4年に医薬品、医療機器等の
品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145 号。以下「医薬品医療
機器等法」という。)の改正が行われ、国民のニーズに応える優れた医薬品、医療機器等をよ
り安全・迅速・効率的に提供するための仕組み作りや、住み慣れた地域で患者が安心して医薬
品を使うことができる環境の整備を進めてきた。また、デジタルトランスフォーメーションへ
の対応が薬事行政にも求められており、例えばリアルワールドデータの薬事承認・市販後安全
対策への利活用など、医薬品・医療機器等の有効性・安全性の確保のために、科学的根拠に基
づき、かつ国際規制調和を念頭に置いた、規制のあり方を検討する必要がある。さらに、少子
高齢化のさらなる進行が予測される中、人口構造の変化や地域の実情に応じた医薬品提供体制
の確保のため、薬剤師の職能拡大、資質向上が課題となっている。加えて、不良な医薬品の取
締りや薬物乱用の防止、献血の推進など、不断の対策が求められている。
(2)事業目標
医薬品・医療機器等に係る政策的課題の解決に向けて、薬事承認、市販後安全対策、薬事監
視、薬物乱用対策、血液事業及び医薬品販売制度等を政策的に実行するために必要な規制(レ
ギュレーション)について、科学的合理性と社会的正当性に基づいて整備するための研究を行
う。
(3)研究のスコープ
〇薬事承認における審査基準の整備及び国際調和に資する研究
〇市販後安全対策に資する研究
〇薬事監視、薬物乱用対策に資する研究
〇血液製剤の安定供給・安全対策に資する研究
〇薬剤師の資質向上、薬剤師業務の在り方に関する研究
(4)期待されるアウトプット
〇国内で未だ流通していない医薬品等の早期実用化、新規医薬品等の科学的根拠に基づく有効
性、安全性の的確な評価・審査を可能とするため、薬事当局における医薬品等の評価・審査
に関する基準策定等を行う。
〇承認時には認められていなかった副作用等の情報を迅速に収集、周知し、新規の医薬品、医
療機器等の適正使用を促進するため、医療情報データベースの利活用の検討、副作用情報の
評価の見直し等を行う。
305