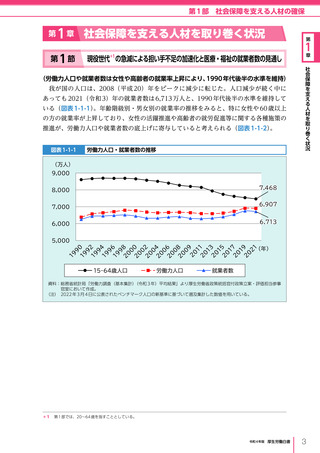
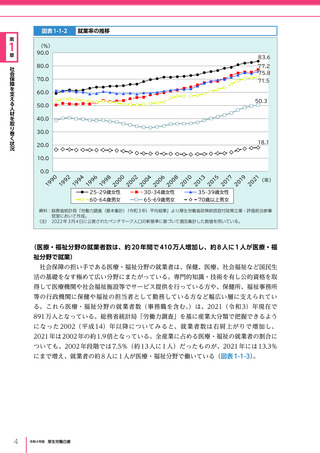
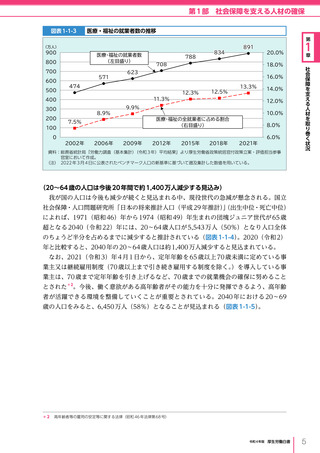
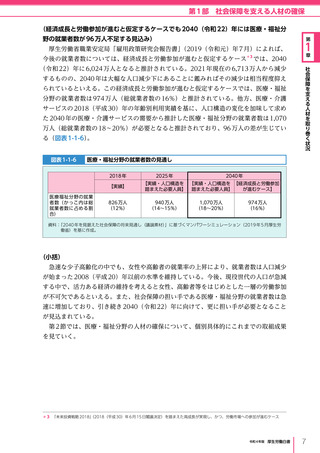
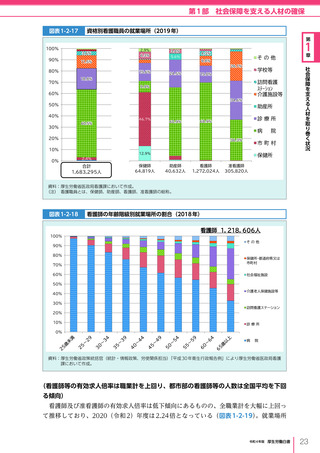
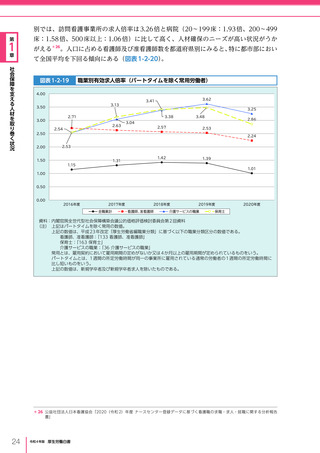
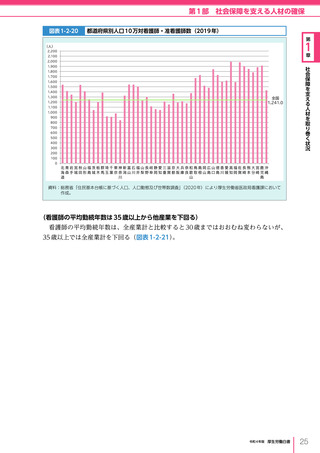
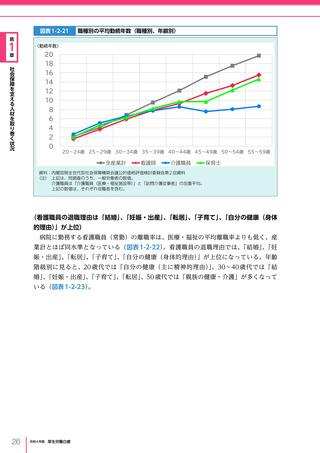
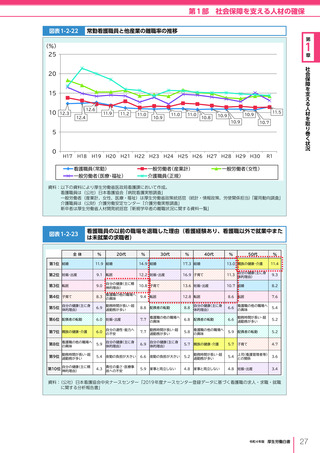
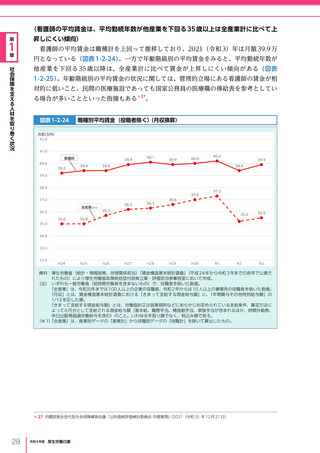
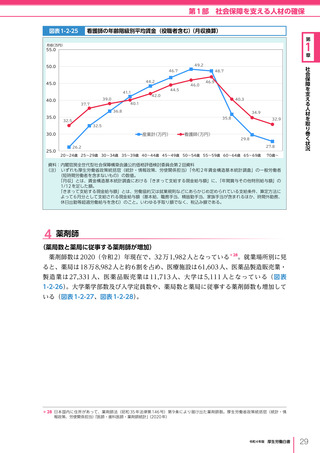
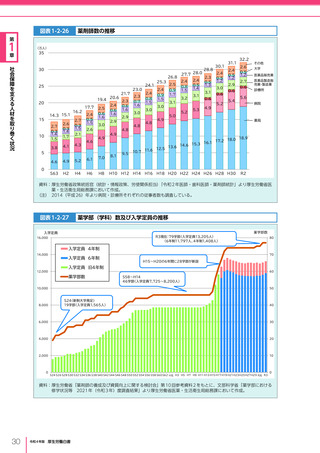
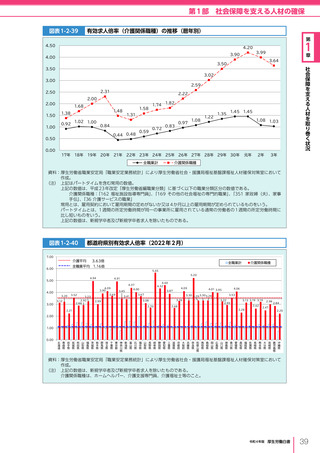
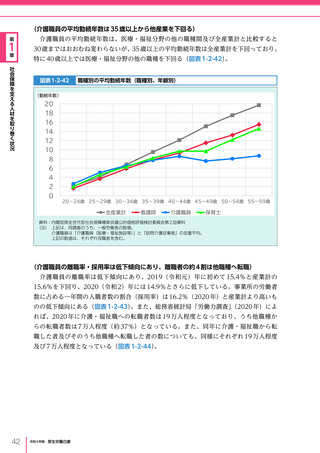
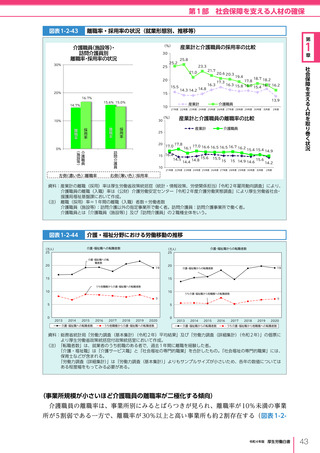
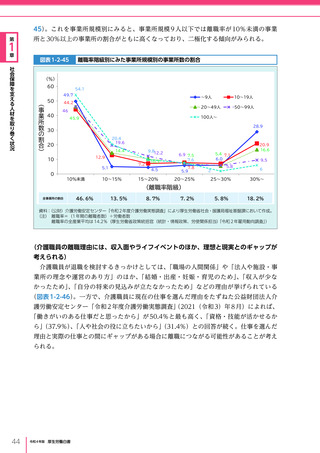
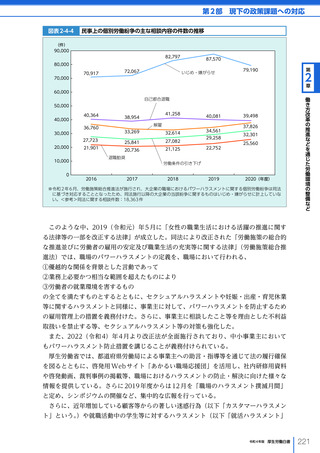
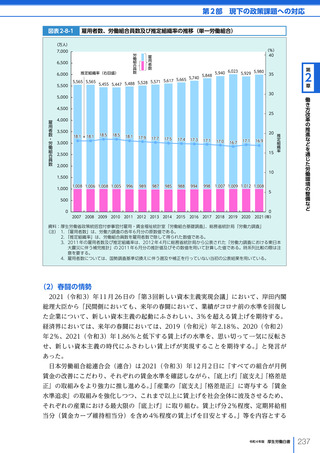
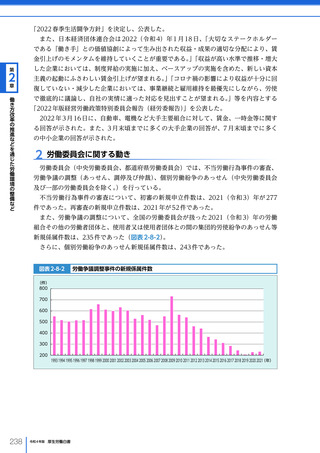
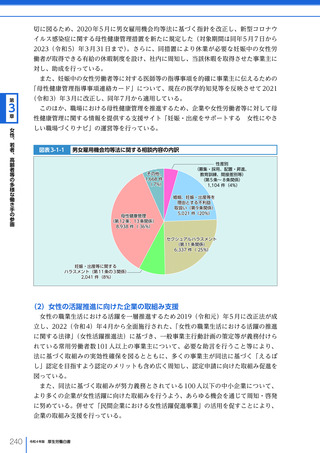
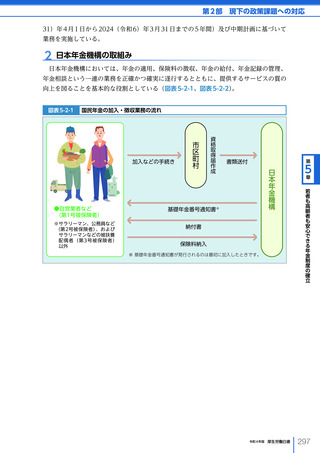
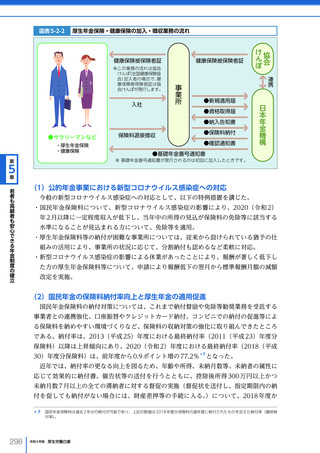
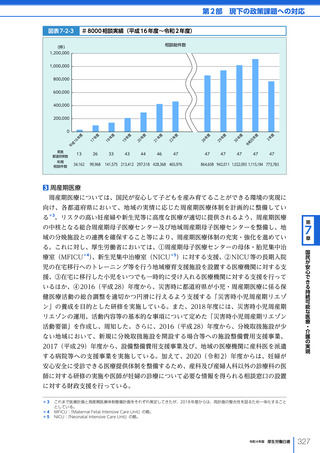
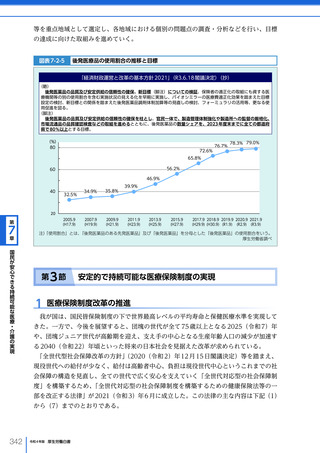
令和4年版厚生労働白書 (332 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/hakusyo/kousei/21/dl/zentai.pdf |
| 出典情報 | 令和4年版厚生労働白書(9/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ンラインによる研修を実施している。
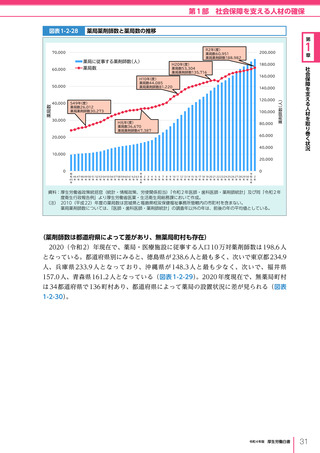
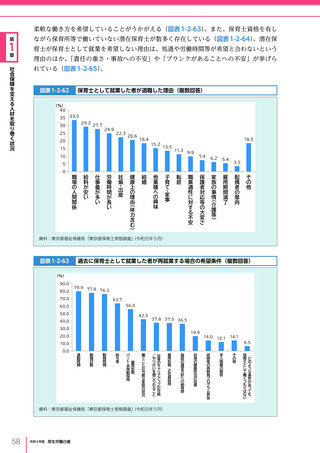
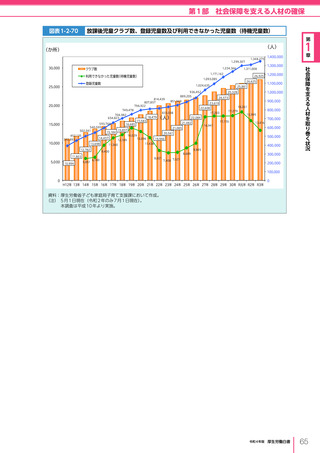
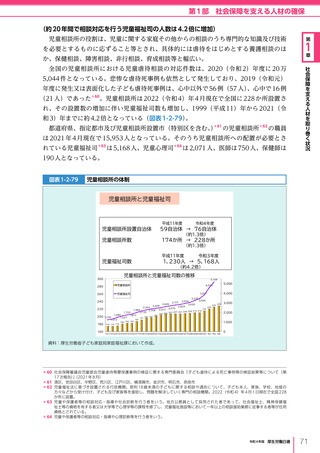
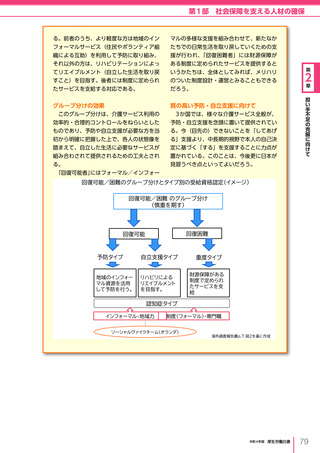
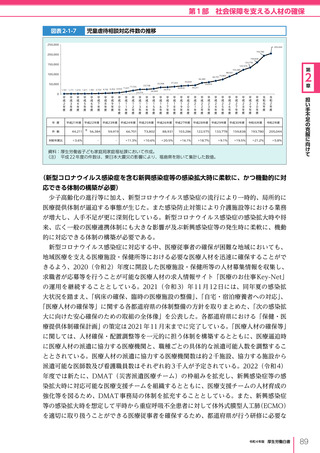
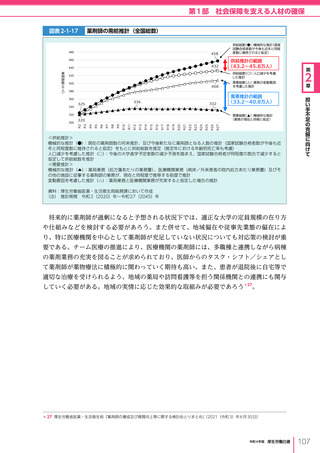
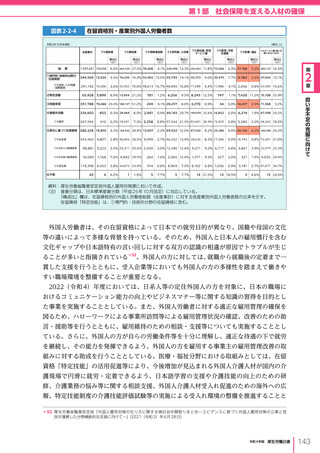
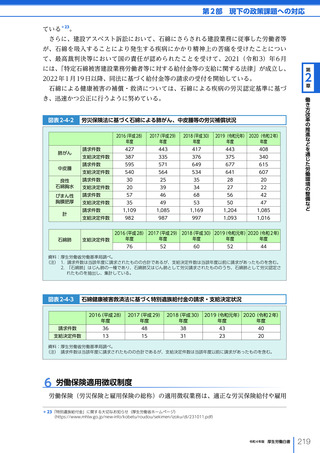
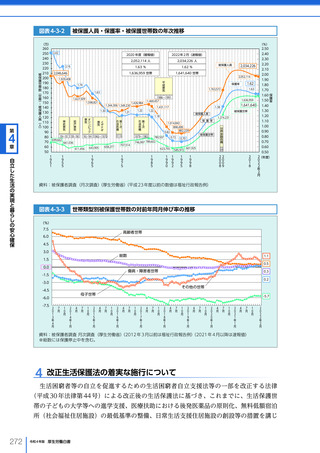
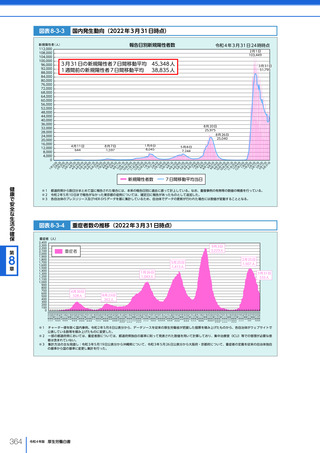
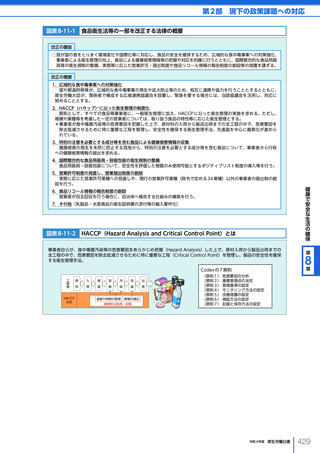
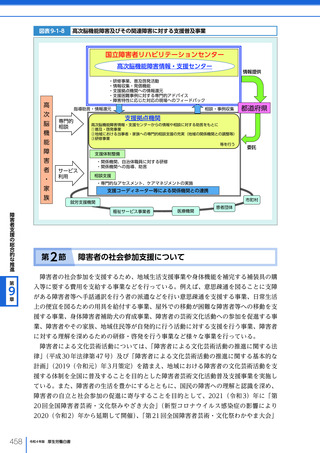
図表 6-4-1
基本的
考え方
医療の国際展開の考え方
日本の健康寿命・医療
に関する知見・経験を共有
感染症対策
医療水準
向上のため
の課題例
医療水準の向上に向けた
医療従事者等の
派遣や受入による人材育成
我が国医療への
親和性向上
生活習慣病対策
母子保健
我が国の
医薬品・医療機器
の利用
保健システム確立
医療提供体制
プライマリケア
保健所整備
病院整備
予防・早期診断
高度医療技術
医療保険制度
制度導入
カバー率拡大
医療費の抑制
薬事規制
品質管理・審査の迅速化
アジア
第
国・地域
等
欧州、中東 イタリア、フィンランド、サウジアラビア 等
章
6
インド、インドネシア、ベトナム
医療関連イノベーションの推進
北中南米
キューバ、ブラジル、メキシコ
等
※医療・保健分野の協力覚書締結国の例
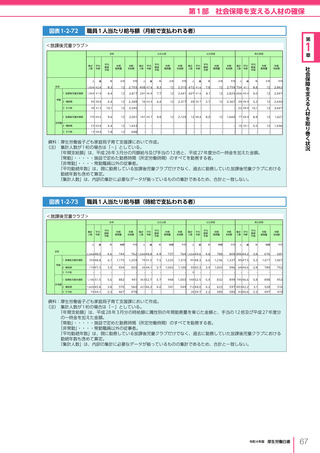
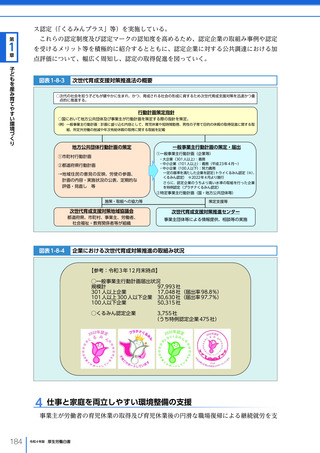
(3)医薬品・医療機器等の国際規制調和・国際協力の推進
「アジア健康構想に向けた基本方針」
(2016(平成 28)年 7 月 29 日健康・医療戦略推進
本部決定、2018(平成 30)年 7 月 25 日改定)に基づき、健康・医療戦略推進本部は、
「アジア医薬品・医療機器規制調和グランドデザイン」(2019(令和元)年 6 月 20 日)及
び同実行戦略(2020(令和 2)年 7 月 14 日)を策定した。この中では、アジア諸国にお
いて経済発展や疾患構造の変化により、優れた医薬品・医療機器等に対するニーズが高
まっており、アジア諸国の国際規制調和に支援・協力し、垣根のないマーケットを整備す
ることで、医薬品・医療機器等への迅速なアクセスを可能にするよう取り組むことが必要
とされている。
同グランドデザインに基づき、令和 2 年度から国立研究開発法人日本医療研究開発機構
(AMED)を通じて、日本の臨床研究拠点の能力・経験をベースとして、アジア地域の研
究拠点への専門家の派遣、人材育成、データ収集及び臨床研究推進部門の整備や、設備整
備等の支援を行っている。また、アジア地域における規制調和を推進するのに中核的な役
割を担うのが、
(独)医薬品医療機器総合機構(PMDA)に設置された「アジア医薬品・
医療機器トレーニングセンター」である。アジアを中心とする海外の規制当局担当者に医
薬品・医療機器の審査や安全対策等に関する研修を実施しており、薬事規制構築に向けた
経験・ノウハウを提供することで、将来の規制調和に向けた基盤作りを継続して進めてき
ている。新型コロナウイルスの影響下にあった 2020 年度もオンライン形式の研修を積極
318
令和 4 年版
厚生労働白書