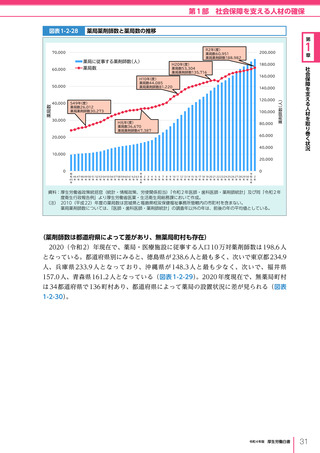
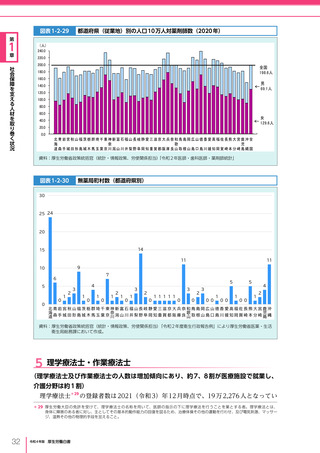
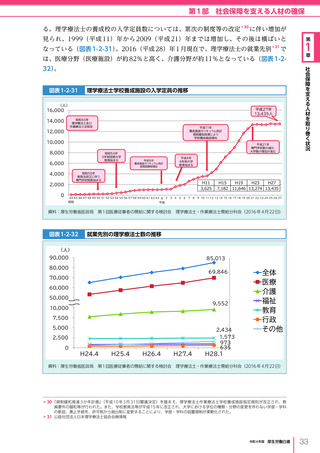
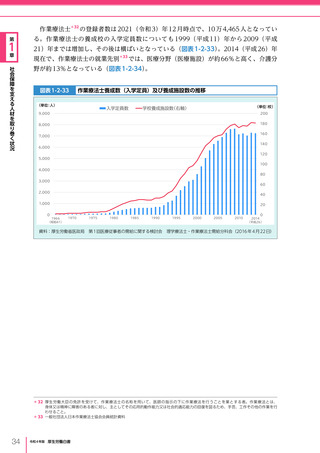
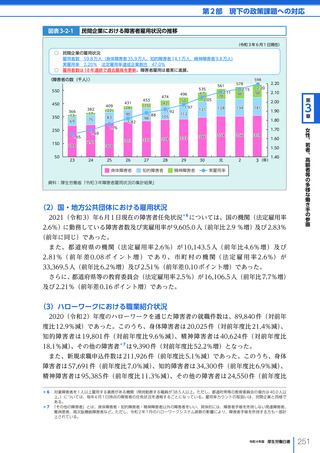
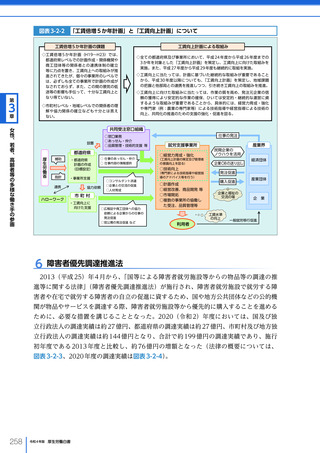
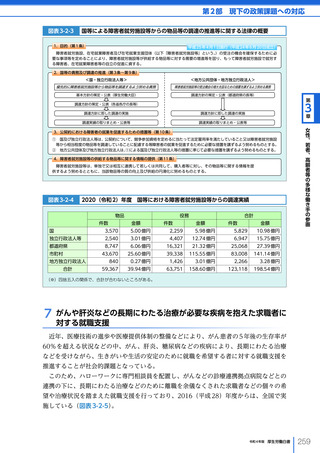
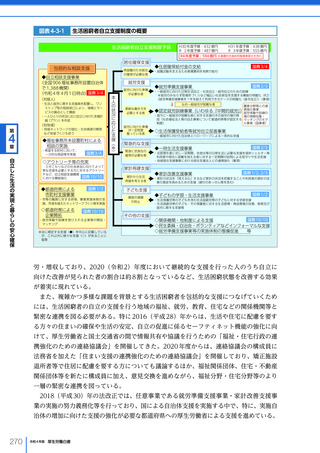
令和4年版厚生労働白書 (328 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/hakusyo/kousei/21/dl/zentai.pdf |
| 出典情報 | 令和4年版厚生労働白書(9/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
うべく「条件付き早期承認制度」を導入した。本制度は、2020 年 9 月の「医薬品、医療
機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律」
(令和
元年法律第 63 号)の施行により法制化された。この制度の、製造販売後の有効性・安全
性の確認において、リアルワールドデータを活用することができるとされていることも踏
まえ、医薬品の製造販売後の調査に医療情報データベースを利用した際の再審査及び再評
価の申請書に添付する資料の信頼性を確保するため、
「医薬品の製造販売後の調査及び試
験の実施の基準に関する省令等の一部を改正する省令」
(平成 29 年厚生労働省令第 116 号)
を公布した。また、2018(平成 30)年 4 月より PMDA において医療情報データベース
である MID-NET の本格運用が開始され、全国の大学病院等 570 万人超(2021(令和 3)
年 12 月末現在)のリアルワールドデータを医薬品等の製造販売後調査に活用できるよう
になった。引き続き、2017 年に京都で開催された薬事規制当局サミットでの議論等も踏
まえ、国際的な意見交換を推進しつつ、薬事規制における更なるリアルワールドデータの
活用について、検討を進める。
医薬品については、上記のほか、「医療上の必要性の高い未承認薬・適応外薬検討会議」
において、学会・患者団体等から提出された要望のうち、医療上の必要性が高いとされた
第
章
6
ものに対し、関係製薬企業に開発要請等を行い、開発を促進する取組みを実施している。
医療機器についても、「医療ニーズの高い医療機器等の早期導入に関する検討会」におい
て、学会・患者団体等から提出された要望のうち、医療上の必要性が高いとされたものに
医療関連イノベーションの推進
対し、関係企業への開発要請や承認審査における優先審査指定を行う等、開発を促進する
取組みを実施するとともに、医療機器規制と審査の最適化のための協働計画を策定し、行
政側、申請者側の双方が協働しながら、研修の充実による申請及び審査の質の向上など各
種の取組みを実施することにより、承認までの期間の更なる短縮と審査期間の標準化を図
ることとしている。製造技術のイノベーションの活用やグローバル化したサプライチェー
ンの効率的な管理を促進するため、また、医療機器については、医薬品と比較してライフ
サイクルが短く承認後も頻回の変更が行われることを鑑み、2020(令和 2)年 9 月の「医
薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法
律」(令和元年法律第 63 号)の施行により、変更計画確認手続制度を導入した。これは、
予め変更計画の確認を受けておくことで、通常であれば承認事項一部変更承認を受ける必
要がある承認事項の変更を届出により行うことが可能となる制度であり、市販後の医療機
器の改良の迅速化等に資することが期待される。
2014(平成 26)年 11 月の「医薬品、医療機器等の品質、有効性及び安全性の確保等
に関する法律」の施行により、疾病の診断、治療等に用いられるプログラムの提供が法の
規制対象となり、その製造販売には厚生労働大臣による承認等を要することとなった。
2016(平成 28)年 3 月には「医療機器プログラムの承認申請に関するガイダンス」を公
表し、医療機器プログラムの承認申請における要点を明確化し、承認申請資料の作成のた
めの参考として提供している。医療機器プログラムは、従来の医療機器とは異なる特性を
有しており、実用化を促進していくためには、その特性を踏まえた承認制度や審査体制の
整備が必要であることから、2020(令和 2)年 11 月に「医療機器プログラム実用化促進
パッケージ戦略」
、通称「DASH for SaMD」を公表し、最先端の医療機器プログラム等
314
令和 4 年版
厚生労働白書