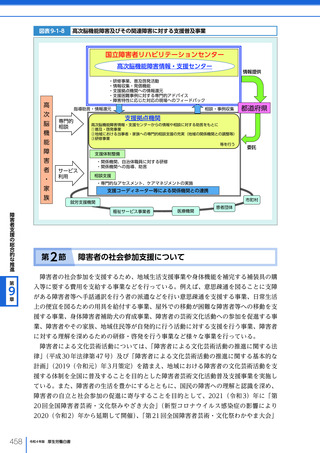
令和4年版厚生労働白書 (326 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/hakusyo/kousei/21/dl/zentai.pdf |
| 出典情報 | 令和4年版厚生労働白書(9/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
研究機関等とともに創薬支援ネットワークを構築している。同ネットワークにおいては、
有望なシーズの選定、治験につなげるための戦略の策定・助言、応用研究や非臨床研究を
中心とした技術的助言等を行うことを通じて、実用化の支援を行っている。
(3)臨床研究・治験環境の整備
革新的な医薬品・医療機器の創出のためには、臨床研究・治験の推進が不可欠である。
厚生労働省では、日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床
研究を推進するため、国際水準の臨床研究や医師主導治験の中心的役割を担う病院を
2015(平成 27)年 4 月から、臨床研究中核病院(2022(令和 4)年 4 月 1 日現在、14 病
院)として医療法上に位置付けている。臨床研究中核病院は、質の高い臨床研究・治験を
自ら実施するだけでなく、他施設における臨床研究・治験の計画立案や実施について支援
する Academic Research Organization(ARO)機能を有することから、ARO 機能を
活用し多くのエビデンスを構築することで、我が国における様々な革新的医療技術の創出
を推進している。
厚生労働省としては、2019(令和元)年に取りまとめられた「臨床研究・治験の推進
第
章
6
に関する今後の方向性について」を踏まえ、更なる臨床研究・治験の推進のため、小児疾
病・難病等の研究開発が進みにくい領域の取組み等を進める。
また、引き続き、臨床研究中核病院を中心に、研究者が国際共同臨床研究・治験を円滑
医療関連イノベーションの推進
に実施するための体制構築や、臨床研究従事者等の養成を行うなど、国内における臨床研
究環境の更なる向上を目指していく。なお、これらの事業については、国民の健康寿命の
延伸の観点から、医療分野の研究開発を政府として総合的に推進するため、2015 年 4 月
に設立された国立研究開発法人日本医療研究開発機構(AMED)において、文部科学省
で整備している橋渡し研究支援拠点と一体的に整備を進め、革新的な医薬品・医療機器の
創出を加速することとしている。
さらに、疾患登録システムを活用して治験対象となる患者を把握すること等で、効率的
な治験が実施できる環境を整備することにより、企業等による国内臨床開発を加速し、新
薬等の早期開発により国民の健康寿命を延伸するため、国立高度専門医療研究センター
(ナショナルセンター)や学会等が構築する疾患登録システムなどの利活用を促進する
「クリニカル・イノベーション・ネットワーク」の取組みを推進している。
(4)臨床研究に対する信頼性確保への取組み
2013(平成 25)年以降、臨床研究においてデータの操作や利益相反行為という複数の
不正事案が発覚したことを契機に、厚生労働省では、研究の信頼性確保のため、2015
(平成 27)年 4 月、従来の研究倫理指針にモニタリング・監査等に関する規定を新設した
「人を対象とする医学系研究に関する倫理指針」
(平成 26 年文部科学省・厚生労働省告示
第 3 号)を施行した(第 6 章第 2 節 4 を参照)
。
また、未承認・適応外の医薬品等の評価を行う臨床研究を実施する場合の必要な手続、
臨床研究に関する資金等の提供に関する情報の公表の義務等を定めた「臨床研究法」
(平
成 29 年法律第 16 号)を 2018(平成 30)年 4 月から施行した。
312
令和 4 年版
厚生労働白書