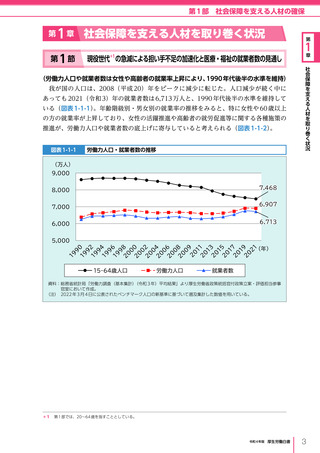
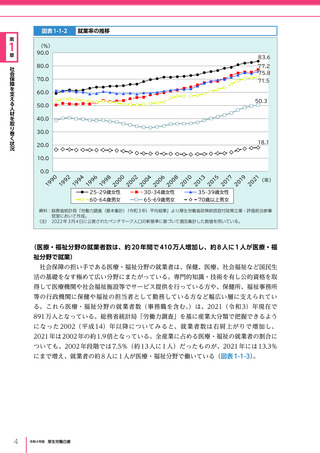
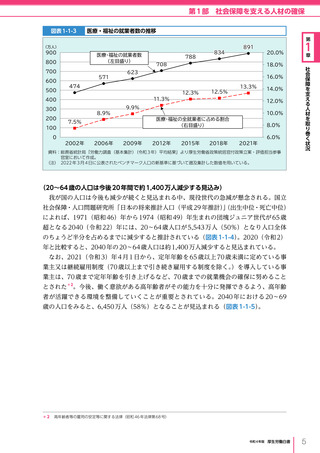
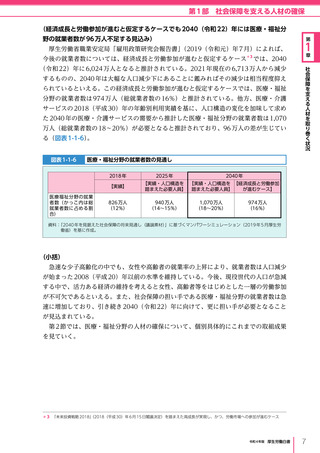
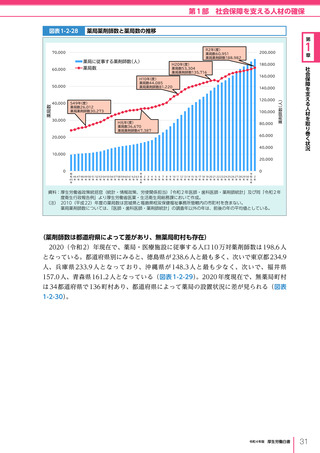
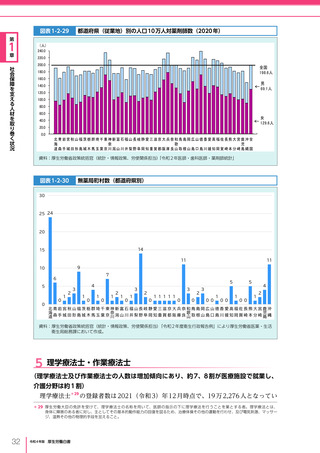
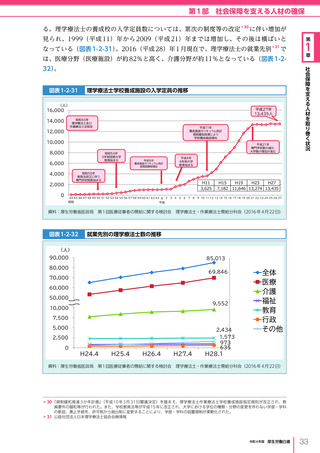
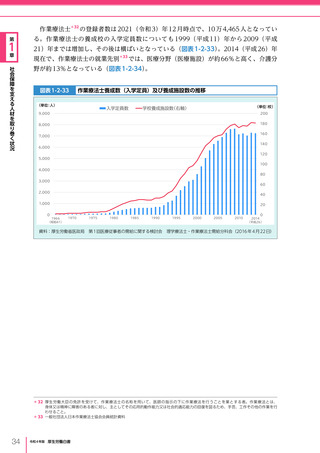
令和4年版厚生労働白書 (327 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/hakusyo/kousei/21/dl/zentai.pdf |
| 出典情報 | 令和4年版厚生労働白書(9/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
現下の政策課題への対応
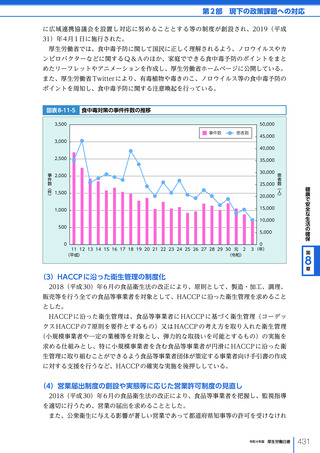
臨床研究法に規定する臨床研究については、実施計画等を厚生労働省が整備するデータ
ベース(jRCT)に記録し、公表することが定められている。また、「医薬品、医療機器
等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律」
(令和元年
法律第 63 号)の施行に伴い、2020(令和 2)年 9 月から治験の実施状況等についても公
表が義務付けられたことを受け、治験の実施状況等についても jRCT において公表してい
る。さらに、jRCT 及び民間のデータベースに登録された臨床研究等のデータは「臨床研
究情報ポータルサイト」
(Web 上に公開)において統合検索が可能であり、国民・患者は、
現在どのような臨床研究等が進行しているか、自身が検索した臨床研究等に参加できるか
どうか等を確認することができる。
第 2 期「健康・医療戦略」(2020 年 3 月 27 日閣議決定)及び臨床研究法の附則に基づ
き施行後 5 年に係る見直しの検討を 2021(令和 3)年 1 月から開始し、同年 12 月に「臨
床研究法施行 5 年後の見直しに係る検討の中間取りまとめ」を公表した。引き続き見直し
の検討を進めていく。
(5)医薬品・医療機器・再生医療等製品の承認審査の迅速化等
医薬品等の承認審査の迅速化に向けては、これまでも(独)医薬品医療機器総合機構
全対策も図りつつ、世界最速レベルの審査期間を堅持するとともに、業務の質の向上のた
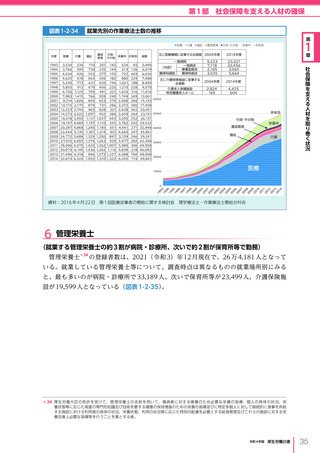
網羅的調査)の手法の確立やレギュラトリーサイエンスに基づき、先駆け審査指定制度、
条件付き早期承認制度など審査迅速化に向けた対応を強化すること等としており、そのた
めの更なる体制強化を行っているところである。
なお、2013(平成 25)年 10 月に開設した PMDA 関西支部では、レギュラトリーサイ
エンス総合相談・レギュラトリーサイエンス戦略相談及び製造所の製造管理・品質管理に
係る実地調査を実施しているところであるが、2016(平成 28)年 6 月から高度なテレビ
会議システムを導入し、治験デザインなどの全ての相談を実施している。
医療関連イノベーションの推進
め、ホライゾンスキャニング(レギュラトリーサイエンスに基づいた革新的技術に対する
6
章
ところである。2019(令和元)年度からの PMDA の第四期中期目標期間においては、安
第
(Pharmaceuticals and Medical Devices Agency:PMDA)の体制強化を図ってきた
また、厚生労働省では、世界に先駆けて革新的医薬品等の実用化を促進するため、
2014(平成 26)年 6 月に「先駆けパッケージ戦略」を取りまとめた。この中では、世界
に先駆けて日本で開発され、早期の治験段階で著明な有効性が見込まれる革新的な医薬品
等について、優先的に審査を行い、早期の承認を目指す「先駆け審査指定制度」をはじ
め、基礎研究から臨床研究・治験、承認審査、保険適用、国際展開までの対策を一貫して
取り組むこととされている。2015(平成 27)年度から 2019 年度まで「先駆け審査指定
制度」の試行的運用を行い、対象品目を指定した。本制度は、2020(令和 2)年 9 月の
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正す
る法律」(令和元年法律第 63 号)の施行により法制化され、
「先駆的医薬品等」として指
定をされた医薬品及び医療機器等の世界に先駆けた早期承認を目指している。
さらに、2017(平成 29)年には、有効な治療方法が乏しい重篤な疾患に用いる医薬
品・医療機器のうち、患者数が少ない等の理由で検証的な臨床試験の実施や臨床データの
収集が困難なものについて、一定の有効性、安全性を確認した上で、製造販売後に有効
令和 4 年版
厚生労働白書
313