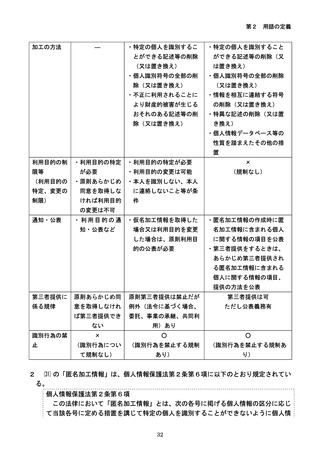
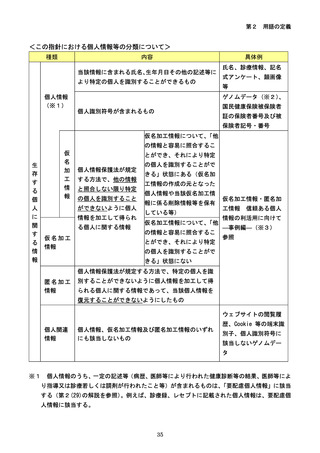
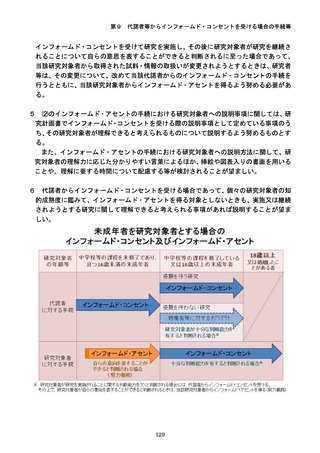
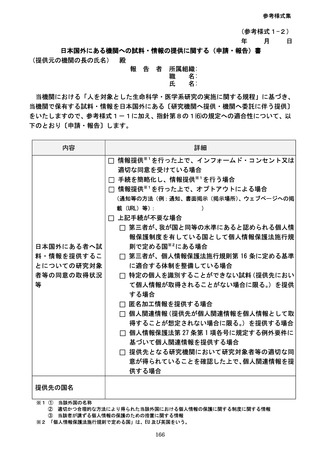
参考資料3-2:人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58031.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第11回 5/22)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
各研究機関の判断により適宜記載事項を追加してよい。
なお、研究の実施に関連して必要な書類については、各記載事項に関連付けることによ
り、研究計画書に含まれるようにする必要がある。
2
①の規定に関しては、第7⑴②の解説を参照。なお、①の「研究者等」には、試料・情
報の収集・提供に携わる者を含む。
3
③の規定に関して、期間を定めない場合は、その旨を記載する必要がある。
4
⑤の規定に関しては、第7⑴⑦の解説を参照。
5
⑥の規定に関しては、第7⑴⑧の解説を参照。
6
⑦の規定に関しては、第7⑴⑨の解説を参照。
7
⑧の規定に関しては、第7⑴⑩の解説を参照。
8
⑨の「収集・提供終了後」とは、③の規定による「試料・情報の収集・提供の期間」が
満了したときをいう。なお、収集・提供終了後も、当該試料・情報について第 13 の規定
に従って適切に保管等がなされる必要がある。
9
⑩の規定に関しては、第7⑴⑫の解説を参照。
10
⑪の規定に関しては、第7⑴⑮の解説を参照。
11
⑬の規定に関しては、第7⑴⑭の解説を参照。
12
⑭の規定に関しては、第7⑴㉔の解説を参照。
72