参考資料3-2:人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス (143 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58031.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第11回 5/22)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
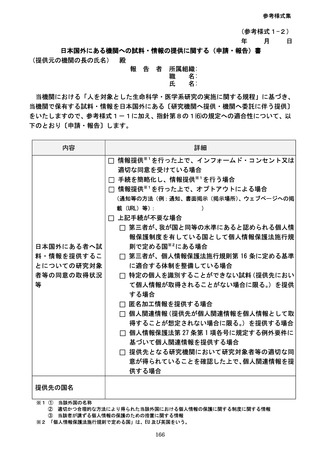
内容を該当機関同士で確認した上で、それぞれの研究機関の長の連名で提出することでも
良い。
6
⑴の規定により大臣へ報告する内容は、倫理審査委員会の意見を聴いて必要な対応を行
った上で、その対応状況・結果を含めた報告とする。なお、この際の倫理審査委員会は、
当該研究の内容及びこれまでの審査の内容を把握していることから、当該研究を審査して
いる倫理審査委員会に限る。
7
重大な不適合については、その事案ごとに報告時期は異なるが、「速やかに」対応する
必要がある。また、「この指針に適合していないことを知った場合」と規定しており、こ
の指針の施行以前に実施された研究に遡及してこの指針を適用することはないが、臨床研
究指針及び医学系指針においても同規定があり、臨床研究指針に則って実施された臨床研
究においては当該臨床研究指針の規定に則り、医学系指針に則って実施された医学系研究
においては当該医学系指針の規定に則り、厚生労働大臣への報告対象となり得る。
8
⑴の規定による公表の方法については、公表の内容に応じて検討されるべきであるが、
例えば、報道機関に対し会見を行うことや、研究実施機関のホームページへ掲載すること
等が考えられる。
9
国外で実施される研究については、第3の3⑴に基づきこの指針に従って実施された場
合は、⑴の規定に基づく報告の対象となり得る。
10
⑵の「調査」とは、大臣が当該研究機関の研究実施体制等を確認するため、必要と判断
した場合に実施される。
140