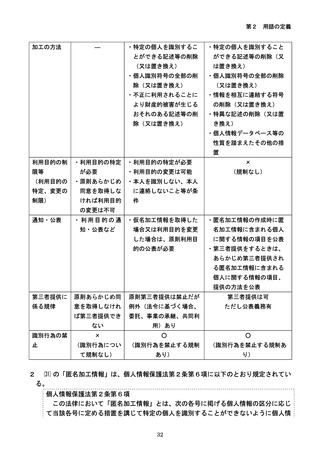
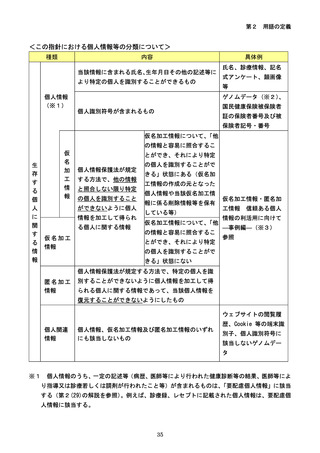
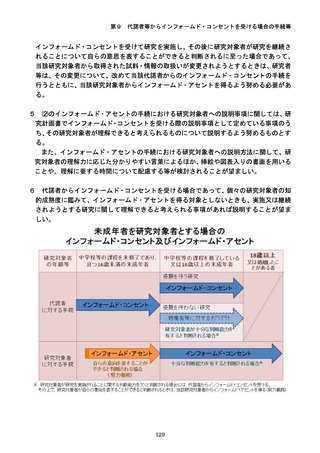
参考資料3-2:人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58031.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第11回 5/22)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
共有し、各研究機関の研究責任者はそれをもって当該研究機関の長に研究の実施の許可を
受ける必要がある。
なお、この場合の研究代表者が所属する機関以外の共同研究機関において、再度個別に
審査をすることは不要と考える。
5
⑷の「公衆衛生上の危害の発生又は拡大を防止するため緊急に研究を実施する必要があ
ると判断される場合」は、感染症など公衆衛生上の危害の発生又は拡大が差し迫り、倫理
審査委員会の意見を聴くいとまもない状況を想定したものである。なお、倫理審査委員会
の意見を聴く前に研究の実施が許可された場合であっても、インフォームド・コンセント
の手続は、第8の規定に基づき行う必要がある。
6
⑷の「遅滞なく」とは、理由のない滞りを生じさせることなくという趣旨である。
7
⑵及び⑸の規定において、研究責任者及び研究代表者は、各研究機関の体制、研究内容
等を踏まえ、研究責任者及び研究代表者間において、十分に協議し審査方法(一括審査又
は個別審査)を決める必要がある。
8
⑸の「審査に必要な情報」とは、既に行われた他の倫理審査委員会における審査の結果
や共同研究機関における許可の状況(審査過程や許可に当たって付された条件等を含む。)、
共同研究機関において既に実施されている研究の進捗状況などの情報が考えられる。「審
査に必要な情報」の範囲・程度については、個々の研究の内容等に応じて判断する必要が
ある。
9
多機関共同研究として倫理審査委員会に審査を求める場合、「一の倫理審査委員会によ
る場合」、「個別の倫理審査委員会による場合」が混在することを妨げるものではない。
10
⑵、⑶及び⑸の規定において、多機関共同研究である場合、各共同研究機関の研究責任
者が各々の研究機関の長による当該研究の実施について許可を受ける必要がある。この場
合、研究機関の長による許可を受けた研究機関から研究を開始することも可能である。
57