参考資料3-2:人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス (73 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58031.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第11回 5/22)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
20
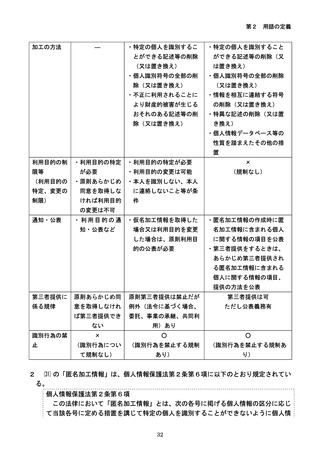
㉒の規定に関して、第6の6⑷において、通常の診療を超える医療行為を伴う研究を実
施された研究対象者が、当該研究の結果により得られた最善の医療(予防、診断及び治療)
を受けることができるよう研究責任者に努力を求めるものである。なお、「研究対象者へ
の研究実施後」とは、研究計画書に記載された研究期間が満了したときではなく、個々の
研究対象者に対して通常の診療を超える医療行為を終了した後を指す。
21
㉓の「委託先の監督方法」については、第6の1⑹の解説を参照。外国にある者に委託
する場合においても同様に記載すること。
22
㉔の「想定される内容」については、将来用いられる可能性のある研究の概括的な目的
及び内容、他の研究機関への提供の目的及び提供する可能性がある研究機関の名称などが
考えられる。
㉔の「研究対象者等が確認する方法」としては、電子メールや文書による通知、ホーム
ページの URL 及び電話番号等が考えられる。
23
㉕の「実施体制」については、モニタリング・監査に従事する者の氏名及び当該研究機
関との関係を含めて記載する必要がある。「実施手順」については、モニタリング・監査
の結果の報告方法を含めて記載する必要がある。
70