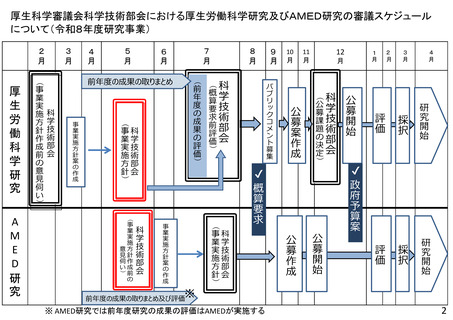
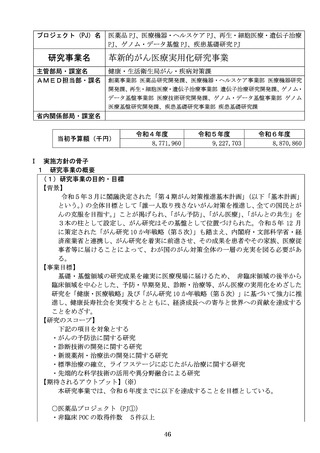
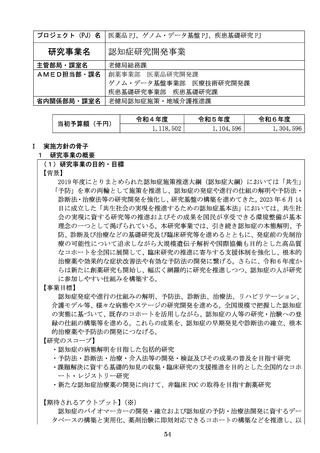
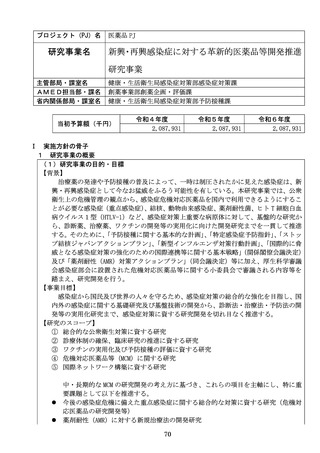
【資料2】令和8年度研究事業実施方針作成のための意見伺い(AMED研究) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57788.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第144回 5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
価に関するガイドライン」、及び、非天然型ペプチド医薬品の非臨床安全性評価にお
ける基本的な原則や、非臨床安全性試験を立案する上での推奨事項をまとめた「非天
然型構造を有する化学合成ペプチド医薬品の非臨床安全性評価に関するガイドライ
ン」の案を作成して規制当局に提出した。
【成果の活用】世界に先駆けてガイドラインを発出することにより我が国における中分
子ペプチド医薬品の開発・承認審査の促進・効率化に貢献する。
【課題名】次世代バイオロジクスの品質安全性評価に関するレギュラトリーサイエンス
研究(令和3~5年度)
【概要】バイオ医薬品の免疫原性に影響するリスク要因(ハザード)と考えられる事項
について整理するとともに、臨床試験での抗薬物抗体評価を中心とした免疫原性評価
において考慮すべき事項、品質管理や製造販売後の適正使用において考慮すべき事項
をまとめた「バイオ医薬品の免疫原性評価に関するガイドライン案」を作成して規制
当局に提出した。
【成果の活用】既に整備されている米欧に加え、日本でも「バイオ医薬品の安全性に関
わる免疫原性評価に関するガイドライン」が整備されることにより、開発推進に必要
なガイドラインの国際的な調和に関する議論の活性化につなげることが期待される。
2 令和7年度に推進する研究課題
(1)継続研究課題のうち優先的に推進する研究課題(増額要求等する課題)の概要、及び
期待される研究成果の政策等への活用又は実用化に向けた取組
【課題名】移植医療への応用を想定した動物由来臓器の品質・有効性・安全性評価法に
関する研究開発
【概要】異種移植の臨床試験開始に向けた指針作りが国際的に本格化しているが、遺伝
子改変動物由来の臓器を患者への適用を目的として製造・販売する際は、その品質・
安全性の確保に関して、様々な検討すべき課題が存在する。そのため、国際的な規制
調和を前提とするレギュラトリーサイエンスのもとで開発・標準化することが、必要
かつ極めて重要である。特に遺伝子改変ブタの最終製品としての臓器の安全性担保に
関する検討(ウイルス等の感染因子の混入防止、及び、臓器の免疫原性評価)が課題
である。したがって、動物由来臓器を用いた移植医療の質の向上のため、安全性担保
に必要な事項を整理する必要がある。
【成果の活用】異種移植に遺伝子改変ブタを用いる際の品質・安全性の担保に関するガ
イドラインの作成、遺伝子改変ブタの生産・管理体制や安全かつ高品質な移植実施体
制の標準化を図ること等により、遺伝子改変動物由来の異種移植に係る医療の質の向
上に寄与する。
(2)新規研究課題として優先的に推進する研究課題の概要、及び期待される研究成果の政
策等への活用又は実用化に向けた取組
<新規医薬品等の開発の環境整備に資する研究>
【課題名】エクソソーム製剤の臨床試験開始に向けた品質安全性確保のための規制要件
に関する研究
【概要】近年、新規モダリティとして、細胞から放出されるエクソソーム(細胞外小胞
の中でも直径 100nm 前後で細胞間情報伝達機能を有するもの)が注目され、国内外で
16