【資料2】令和8年度研究事業実施方針作成のための意見伺い(AMED研究) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57788.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第144回 5/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
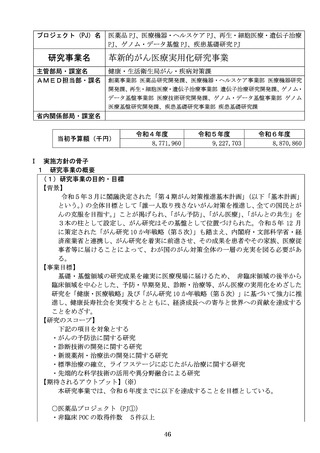
医薬品 PJ、シーズ開発・研究基盤 PJ
研究事業名
臨床研究・治験推進研究事業
主管部局・課室名
AMED担当部・課名
省内関係部局・課室名
医政局研究開発政策課
創薬事業部 規制科学推進課、シーズ開発・研究基盤事業部 拠点研
究事業課
健康・生活衛生局感染症対策部感染症対策課
当初予算額(千円)
Ⅰ
令和4年度
3,470,156
令和5年度
3,470,156
令和6年度
3,800,156
実施方針の骨子
1 研究事業の概要
(1)研究事業の目的・目標
【背景】
有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験
を効率的に実施しなければ、早期の薬事承認に繋がらない。基礎研究の段階から臨床研
究へ移行できるシーズは、約1万分の1以下の割合にとどまっているという問題があ
る。
ア カ デ ミ ア や ベ ン チャ ー 発 の 革 新 的 な シー ズ に つ い て ア カ デミ ア の Academic
Research Organization(ARO)機能を活用した評価を推進するとともに、日本発のアジ
ア地域の国際共同治験により、速やかに日本のみならずアジア各国に革新的な医薬品を
上市する必要性が高まっている。
【事業目標】
日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出する
ため、科学性及び倫理性が十分に担保され得る質の高い臨床研究・医師主導治験等を推
進する。
【研究のスコープ】
・特に希少疾病や小児領域等で患者ニーズや社会的ニーズは高いものの企業が参入しな
い領域において、臨床研究・医師主導治験を支援する。
・疾患登録システム(患者レジストリ)や Decentralized Clinical Trial(DCT:分散
型臨床試験)を活用した効率的な臨床研究・治験を支援する。
・実務家としての生物統計家の育成を目的として、座学的教育を実施する大学院と実践
的研修を実施する病院が一体となった人材育成体制を産学官一体で整備する。生物統
計家育成拠点(東京大学大学院と京都大学大学院)が製薬企業からの寄附金と国の研
究資金を基とし、産学官が一体となって臨床研究・治験の質の向上に繋がる生物統計
家育成のための環境整備を強化する。
・「アジア地域における臨床研究・治験ネットワークの構築事業」において整備した基
盤の継続性の確保及び更なる拠点の整備を推進し、日本主導の国際共同臨床研究・治
験の強化を図る。
【期待されるアウトプット】(※)
<医薬品プロジェクト>
臨床 POC の取得件数 10 件
<シーズ開発・研究基盤プロジェクト>
7