資料2‐1 令和6年度 業務実績評価書(案) (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59633.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第39回 8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中 長 期 目 標
中 長 期 計 画
(2)実用化を目指した研
究・開発の推進及び基盤
整備
精神・神経疾患を有する
人々の社会復帰のための支
援と、地域での生活に即した
治療・ケアの開発、研究所と
病院等、センター内の連携強
化、メディカルゲノムセンタ
ー(MGC)の機能の充実、人材
育成、精神・神経疾患、筋疾
患、認知症性疾患、発達障害
等のレジストリ、コホート及
びバイオリソースの整備・充
実、バイオバンクの充実等に
よる研究基盤の整備・強化、
産学官等との連携強化、研
究・開発の企画及び評価体制
の強化、知的財産の管理強化
及び活用推進、臨床研究機能
の強化、倫理性・透明性の確
保により、研究・開発を推進
する。
また、臨床研究及び治験を
進めるため、症例の集約化を
図るとともに、今後も、これ
らの資源を有効に活用しつ
つ、臨床研究の質の向上、研
究者・専門家の育成・人材確
保、臨床研究及び治験のため
の共通的な基盤の共用、研究
不正・研究費不正使用等防止
への対応、患者との連携及び
国民への啓発活動等への取
組など更なる機能の向上を
図り、基礎研究成果を実用化
につなぐ体制等を強化する。
加 え て 、 ARO ( Academic
Research Organization)を
整備するなど、我が国の臨床
研究の中核的な役割を担う
体制を整備する。
具体的には、センター内や
産官学の連携の強化、治験・
臨床研究の推進やゲノム医
療の実現化に向けた基盤を
充実させ、特に、ナショナル
センター・バイオバンクネッ
トワークを最大限活用し、セ
ンターが担う疾患に関する
難治性・希少性疾患の原因解
明や創薬に資する治験・臨床
研究を推進するために、詳細
な臨床情報が付帯された良
質な生体試料を収集・保存す
るとともに、NC をはじめと
(2)実用化を目指した研
究・開発の推進及び基盤整
備
国立精神・神経医療研究センター
令 和 6 年 度 計 画
主な評価軸(評価の
視点)、指標等
(2)実用化を目指した研究
・開発の推進及び基盤整備
年度評価
項目別評価調書
法人の業務実績等・自己評価
1-2
自己評価
主な業務実績等
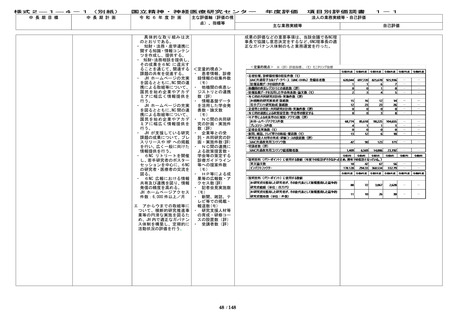
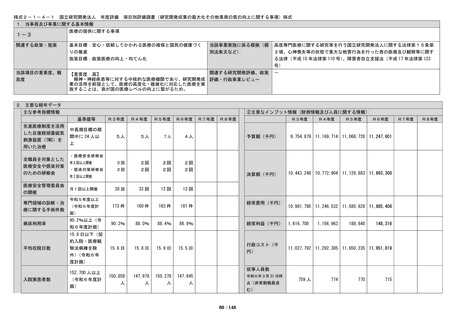
<定量的指標>
(2)実用化を目指した研究・開発の推進及び基盤
整備
■
中長期目標の期
間中に、First in
human(ヒトに初め
て投与する)試験
実施件数につい
て、3件以上達成
する。
■
中長期目標の期
間中に、医師主導
治験実施件数につ
いて、10件以上達
成する。
■
中長期目標の期
間中に、センター
の研究開発に基づ
くものを含む先進
医療承認件数につ
いて、13件以上達
成する。
■
中長期目標の期
間中に、学会等が
作成する診療ガイ
ドラインへの採用
について、20件以
上達成する。
■
中長期目標の期
間中に、臨床研究(
倫理審査委員会に
て承認された研究
をいう。) の実施
件数について、850
件以上達成する。
■
中長期目標の期
間中に、治験(製造
販売後臨床試験を
含む。)の実施件数
について、440件以
上達成する。
■
中長期目標の期
間中に、共同研究
の実施件数につい
て、720件以上達成
する。
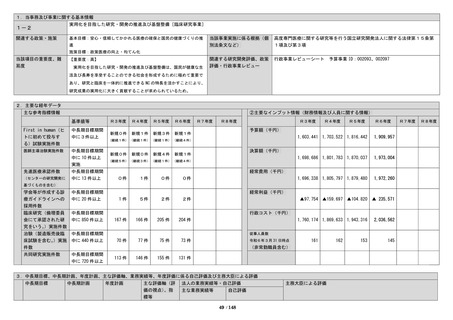
薬物療法など既存の治療法が効かない双極性障
令和6年度における実用化を目指した研究・開発
害の患者のために、新たな治療方法として、先進
の推進及び基盤整備に係る成果は、次のとおり目標
医療制度を活用した反復経頭蓋磁気刺激装置(rT
を上回り「研究開発成果の最大化」に向けて医師主
MS)を用いた治療を実施している。令和6年度は
導治験等の臨床研究実施の取組みについて特に顕著
4名、全施設で令和6年度末までに累計38名に実
な成果の創出や、バイオバンク事業、レジストリ構
施してきた。
築等の取り組みは、実用化を目指した研究・開発の
また、令和4年度から「うつ病(急性期において当 推進及び基盤整備において将来的にも特別な成果の
該療法が実施された患者に係るものであって、薬物 創出の期待が認められる。よって、自己評価をSと
療法に抵抗性を有するものに限る)の患者への反復 している。
経頭蓋磁気刺激療法」が先進医療Bとして告示さ
れ、令和6年度は32例、累計で62例に実施した。目 <目標の内容①>
標症例数は200例であり、引き続きデータ収集を継
当センターの目的に基づき実用化を目指した研究・
続する。
開発の推進及び基盤整備において、以下の項目を評価
指標としている。
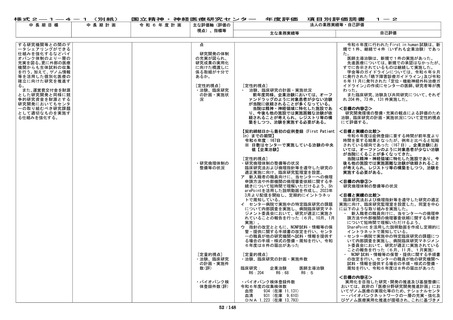
令和6年度のFIH試験については、新規で1件
・First in human 試験の実施件数
、継続で4件(5件とも企業治験)が実施された
・医師主導治験の実施件数
。新規の1件は以下のとおり。
・先進医療承認の承認件数
・学会等が作成する診療ガイドラインへの採用
・ ペリツェウス・メルツバッハー病患者におけ
・臨床研究(倫理審査委員会にて承認された研究)
るION356の髄腔内投与の安全性、薬物動態及び
の実施件数
薬力学を評価する第1b相試験(第I相試験)
・治験(製造販売後臨床試験を含む)の実施件数
・共同研究の実施件数
学会等が作成する診療ガイドラインへの採用等
First in human 試験は、得られた非臨床試験のデ
に向けた主な取組みとしては、精神科領域、脳神経 ータをもとに世界で初めて新規被試験薬をヒトに投
内科領域、などの領域の診療ガイドライン作成委員 与するものである。被験者の安全性を十分配慮した上
会に委員等として積極的に参加した。
で実施すべき非常に困難な治験であるが、トランスレ
ーショナルリサーチを当センターの重要な目的の一
・ 嚥下障害診療ガイドライン
つとして位置づけていることから、中長期目標の期間
中に3件以上実施することを定量的指標としている。
・ 定位・機能神経外科治療ガイドライン
医師主導治験は、治験の企画・立案、準備から管理
までを医師自ら行うことから医師への負担が大きく
他10件。
実施は限られているが、国内未承認薬や適応外使用等
について医師が臨床上の必要性を踏まえて判断して
主導的に取り組むものであることから中長期目標の
期間中に 10 件以上実施することを定量的指標として
いる。
先進医療の承認を受けることは、医療分野において
研究・開発した成果を実用化させたことを示すもので
あることから、中長期目標の期間中に 13 件以上承認
されることを定量的指標としている。
臨床技術の標準とされる学会等が作成する診療ガ
イドラインへの採用件数について中長期目標期間中
に 20 件以上達成することとしている。
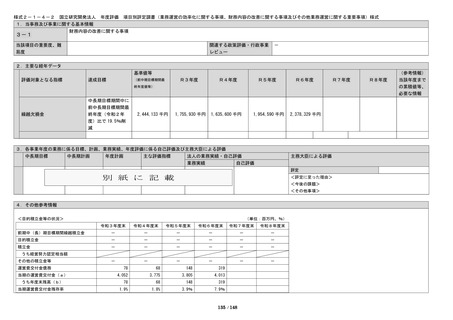
また、臨床研究、治験及び共同研究の実施件数につ
いて、中長期目標期間中にそれぞれ、850 件、440 件、
720 件以上実施することを定量的指標としている。
セ ン タ ー で 医 師 主 導 に よ り 行 わ れ る First in
human 試験では、研究部門において研究・開発した革
新的な成果の実用化に向けた重要過程となることか
ら、その治験の結果が当該成果の発展的展開につなが
るものであり、そうした観点からも重要な指標であ
る。
① 研究開発環境の整備・充実の観点
<目標と実績の比較>
<主な評価軸>
①研究開発環境の
整備・充実の観
51 / 148
<評定と根拠>
評定:S