資料1‐1 令和6年度 業務実績評価書(案) (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59553.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第40回 8/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
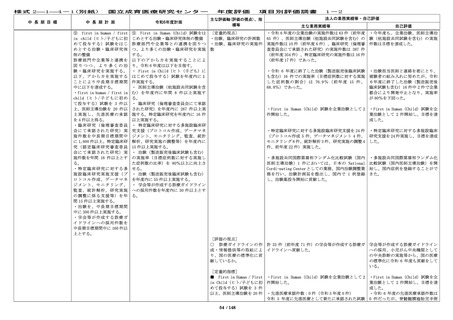
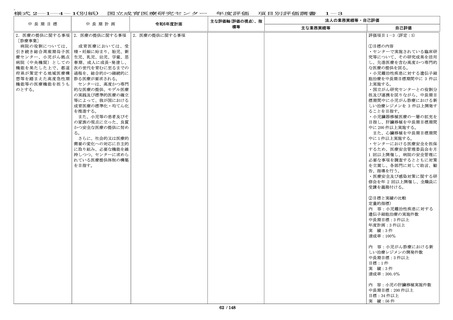
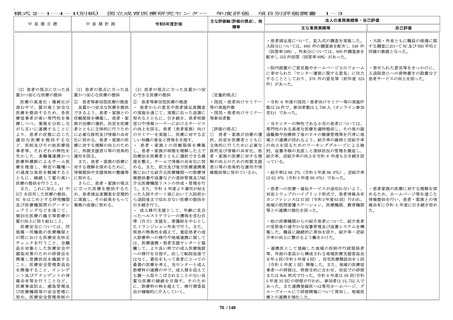
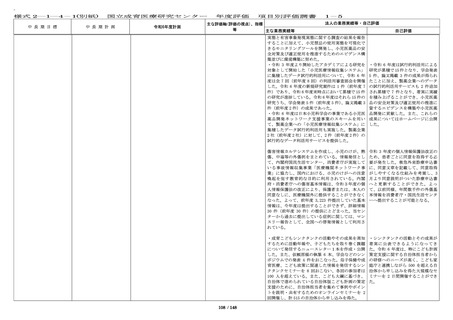
中 長 期 目 標
国立成育医療研究センター
中 長 期 計 画
令和6年度計画
⑨ first in human / first
in child(ヒト/子どもに初
めて投与する)試験をはじ
めとする治験・臨床研究体
制の整備
診療部門や企業等と連携を
図りつつ、より多くの治
験・臨床研究を実施する。
以下、アからカを実施する
ことにより中長期目標期間
中に以下を達成する。
・first in human / first in
child(ヒト/子どもに初め
て投与する)試験を 3 件以
上、医師主導治験を 20 件以
上実施し、先進医療の承認
を 4 件以上得る。
・臨床研究(倫理審査委員
会にて承認された研究)実
施件数を中長期目標期間中
に 1,600 件以上、特定臨床研
究(認定臨床研究審査委員
会にて承認された研究)実
施件数を年間 16 件以上とす
る。
・特定臨床研究に対する多
施設臨床研究実施支援(プ
ロトコル作成、データマネ
ジメント、モニタリング、
監査、統計解析、研究実施
の調整に係る支援等)を年
間 15 件以上実施する。
・治験を、中長期目標期間
中に 300 件以上実施する。
・学会等が作成する診療ガ
イドラインへの採用件数を
中長期目標期間中に 160 件以
上とする。
⑨ First in Human(Child)試験をは
じめとする治験・臨床研究体制の整備
診療部門や企業等との連携を図りつ
つ、より多くの治験・臨床研究を実施
する。
以下のアからカを実施することによ
り、令和 6 年度は以下を目指す。
・ First in Child(ヒト(子ども)に
はじめて投与する)試験を年度内に1
件実施する。
・ 医師主導治験(他施設共同試験を含
む)を年度内に年間 8 件以上実施す
る。
・ 臨床研究(倫理審査委員会にて承認
された研究)を年度内に 267 件以上実
施する。特定臨床研究を年度内に 16 件
以上実施する。
・ 特定臨床研究に対する多施設臨床研
究支援(プロトコル作成、データマネ
ジメント、モニタリング、監査、統計
解析、研究実施の調整等)を年度内に
15 件以上実施する。
・ 治験(製造販売後臨床試験も含む)
の実施率(目標症例数に対する実施し
た症例数の比率)を 80%以上に向上さ
せる。
・ 治験(製造販売後臨床試験も含む)
を年度内に 55 件以上実施する。
・ 学会等が作成する診療ガイドライン
への採用件数を年度内に 30 件以上とす
る。
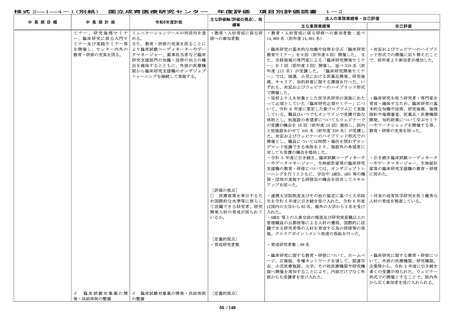
年度評価
項目別評価調書
主な評価軸(評価の視点)、指
標等
〔定量的視点〕
・治験、臨床研究の計画数
・治験、臨床研究の実施件
数
1-2
法人の業務実績等・自己評価
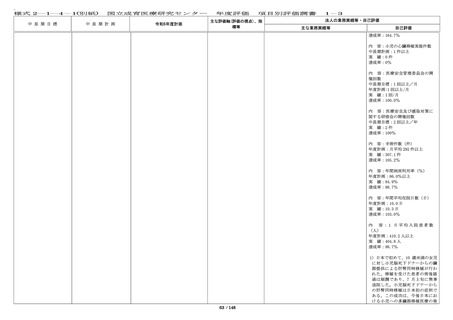
主な業務実績等
自己評価
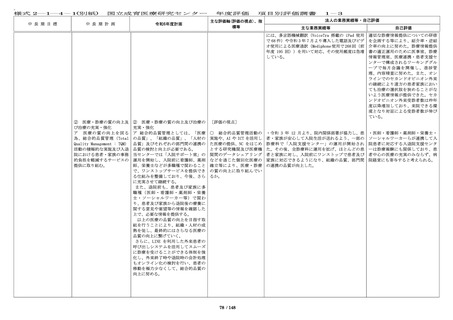
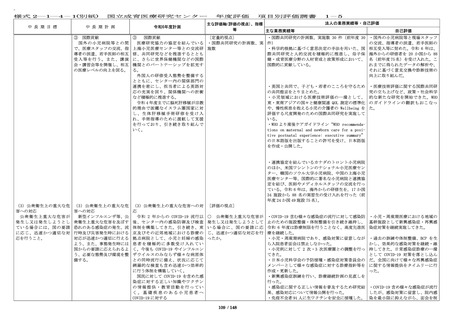
・令和 6 年度の企業治験の実施件数は 63 件(前年度 ・今年度も、企業治験、医師主導治
65 件)、医師主導治験(他施設共同試験を含む)の 験(他施設共同試験を含む)の実施
実施件数は 10 件(前年度 6 件)、臨床研究(倫理審 件数は目標を達成した。
査委員会にて承認された研究)の実施件数は 387 件
(前年度 354 件)、特定臨床研究の実施件数は 16 件
(前年度 17 件)であった。
・令和 6 年度に終了した治験(製造販売後臨床試験
も含む)16 件での実施率(目標症例数に対する実施
し た 症 例 数 の 割 合 ) は 76.9 % ( 前 年 度 15 件 、
68.8%)であった。
・治験担当医師と連絡を密にとり、
被験者の組み入れに努めたが、令和
6年度に終了した治験(製造販売後
臨床試験も含む)16 件中 2 件で企業
都合により開発中止となり、実施率
が 80%を下回った。
・First in Human(Child)試験を企業治験として 2 ・First in Human(Child)試験を企
件開始した。
業治験として 2 件開始し、目標を達
成した。
・特定臨床研究に対する多施設臨床研究支援を 24 件 ・特定臨床研究に対する多施設臨床
(プロトコル作成 5 件、データマネジメント 4 件、 研究支援を 24 件実施し、目標を達成
モニタリング 8 件、統計解析 3 件、研究実施の調整 4 した。
件、前年度 22 件)実施した。
・多施設共同国際第Ⅲ相ランダム化比較試験(国内
医師主導治験)1 件においては、日本の National
Cordi-nating Center としての業務、国内治験調整業
務を行い、治験計画届を提出し、国内で 1 例登録
し、治験薬投与開始に貢献した。
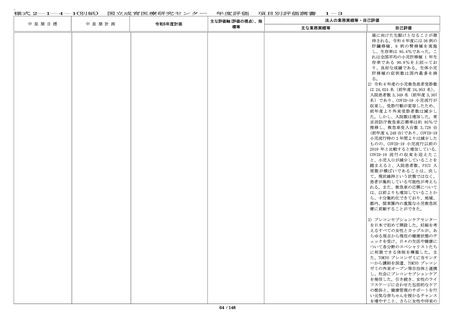
[評価の視点]
○ 診療ガイドラインの作 計 33 件(前年度 71 件)の学会等が作成する診療ガ
成・情報提供等の取組によ イドラインへ貢献した。
り、国の医療の標準化に貢
献しているか。
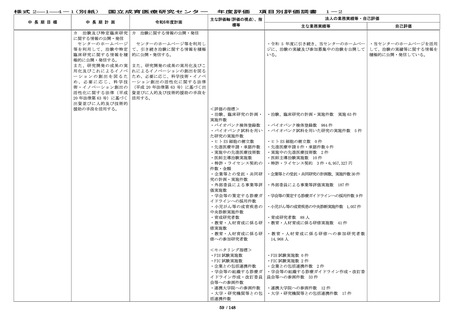
[定量的指標]
■ First in Human / First ・First in Human(Child)試験を企業治験として 2
in Child(ヒト/子どもに初 件開始した。
めて投与する)試験を 3 件
以上、医師主導治験を 20 件 ・先進医療承認件数:0 件(令和 5 年度 0 件)
令和 5 年度に先進医療として新たに承認された試験
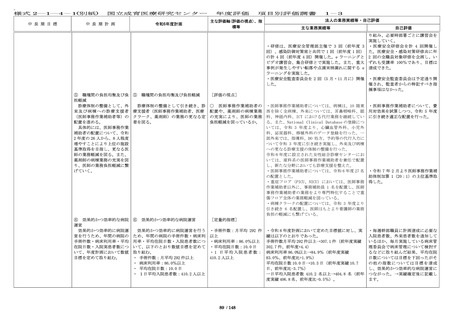
54 / 148
・多施設共同国際第Ⅲ相ランダム化
比較試験(国内医師主導治験)を開
始し、国内症例を登録することがで
きた。
学会等が作成する診療ガイドライン
への採用、小児がん中央機関として
の中央診断の実施等から、国の医療
の標準化に令和 6 年度も貢献をして
いる。
・First in Human(Child)試験を企
業治験として 2 件開始し、目標を達
成した。
・令和 6 年度の先進医療承認件数は
0 件だったが、脊髄髄膜瘤胎児手術