資料1‐1 令和6年度 業務実績評価書(案) (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59553.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第40回 8/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
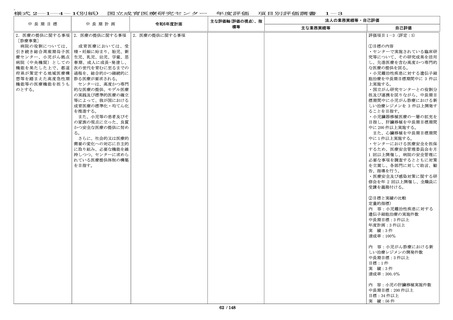
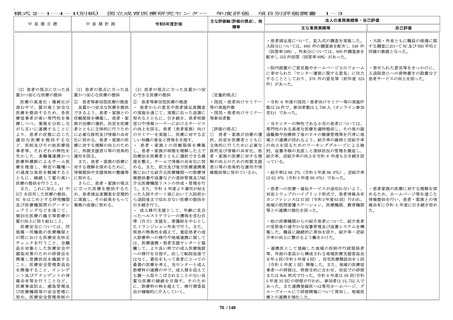
中 長 期 目 標
国立成育医療研究センター
中 長 期 計 画
令和6年度計画
適正に運営し、その情報を
公開する。
また、センター職員の研
究倫理に関する意識・知識
の向上を図るとともに、セ
ンターで実施している治
験・臨床研究について適切
に情報開示する。さらに、
臨床研究の実施に当たって
は、患者及び家族に対して
十分な説明を行い、理解を
得る。
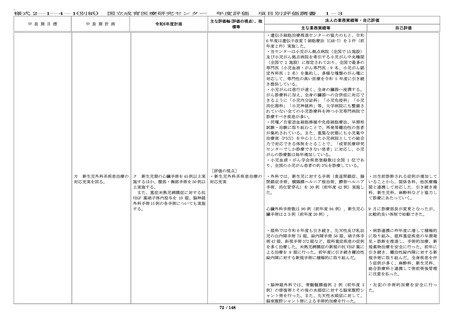
研究審査委員会等を適正に運営する。
倫理審査委員会、臨床研究審査委員
会、及び治験審査委員会(IRB)におい
て審査した治験・臨床研究に関する情
報をホームページ上で公開するととも
に、年 12 回以上これを更新する。
また、センター職員の研究倫理に関
する知識・意識の向上を図るための講
習会を年 6 回以上開催するとともに、
講義動画のオンラインでの視聴や既存
の e-learning の利活用を行う。さら
に、臨床研究に協力していただいてい
る患者及び家族へ情報開示するととも
に、説明文書等に問合せ先の明記や患
者相談窓口での応対など、被験者等へ
の対応を引き続き適切に行う。
年度評価
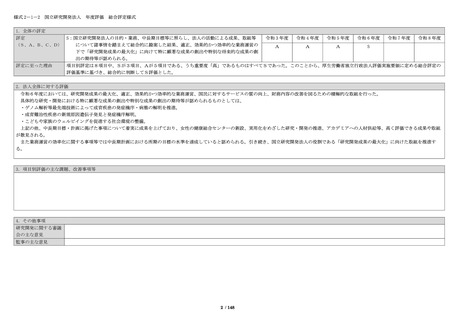
項目別評価調書
主な評価軸(評価の視点)、指
標等
1-2
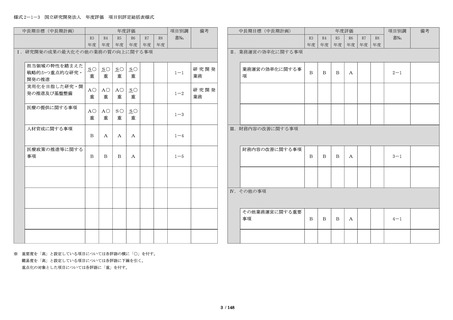
法人の業務実績等・自己評価
主な業務実績等
自己評価
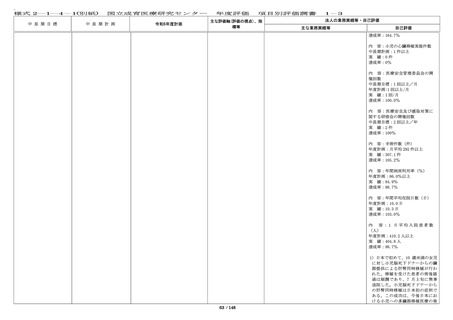
・倫理審査委員会、臨床研究審査委員会及び治験審
査委員会(IRB)において審査した研究に関する情報
を倫理審査委員会は 12 回(前年度 12 回)、臨床研
究審査委員会は 12 回(前年度 12 回)、治験審査委
員会は(IRB)は 11 回(前年度 8 回)更新した。
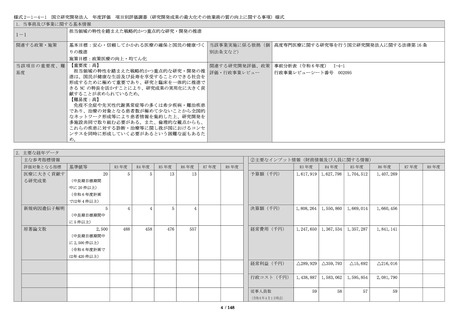
いて、委員会で決定した方針に従い
対応し、一層の適正化・効率化を図
るとともに、倫理審査委員会、臨床
研究審査委員会、及び IRB において
審査した研究課題の内容や審議内
容、審査結果等については、ホーム
ページ上で迅速かつ適正に情報公開
を実施した。
・倫理審査委員会運営に係る費用を
考慮して、引き続き、審査手数料を
設定し請求を行っている。
・臨床研究法に基づき特定臨床研究
を審査する臨床研究審査委員会での
審査を実施している。
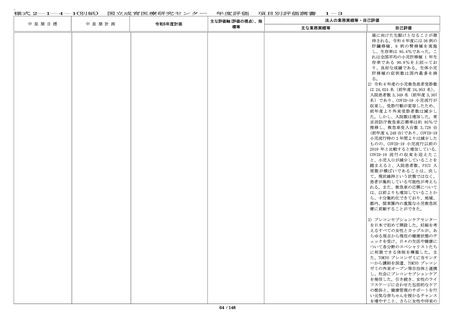
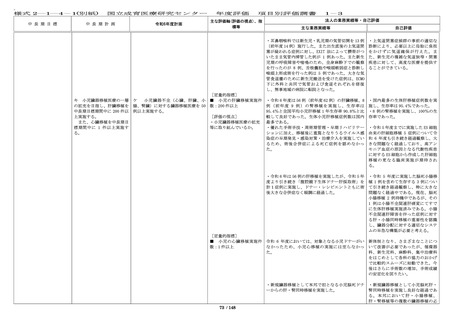
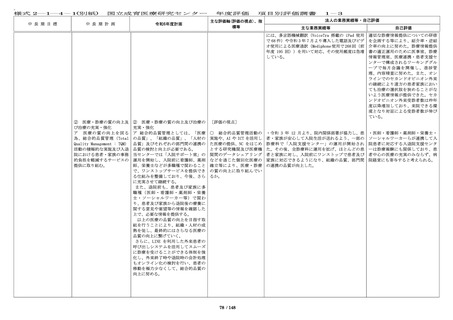
IRB は 8 回(前年度 8 回)更新する等情報公開に努め
た。審査した研究課題や審議内容、審査結果等につ
いては、ホームページ上で迅速に情報開示してい
る。
・臨床研究に関する法令・指針等について、講習会
や電子メール等により職員に周知し、研究倫理に関
する意識・知識の向上を図るための講習会を 11 回
(前年度 11 回)開催した。これらの講習会につい
て、職員はいつでもオンラインで受講可能であり、
他施設の希望者についてもウェビナーで受講の機会
を提供している。受講状況は事務局により確認が可
能で、必要に応じて受講証の発行を行っている。
・倫理指針等の遵守を徹底するため、倫理審査委員
会への申請には臨床研究必須セミナーの受講を必須
としており、受講者を名簿で管理して申請時に受講
の有無を確認する等、職員の研究倫理の向上に令和
5 年度に引き続き務めている。
・倫理指針改訂について、厚生労働省の説明会を開
催し、他の機関からの参加も受け付けた。
・倫理審査委員会、臨床研究審査委員会委員対象の
研修を実施した。
・治験については、GCP 教育研修に関する標準業務
手順書にしたがって、治験責任・分担医師の GCP 教
育を令和 5 年度に引き続き実施している。また、当
センターで実施している治験・臨床研究について
は、倫理審査委員会や IRB のホームページに掲載し
ている。
51 / 148
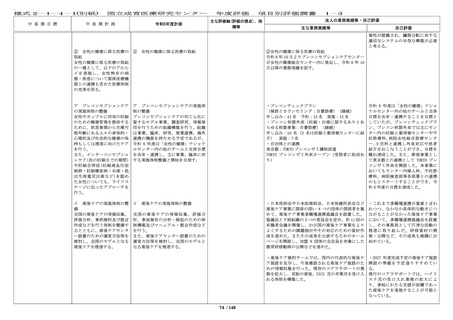
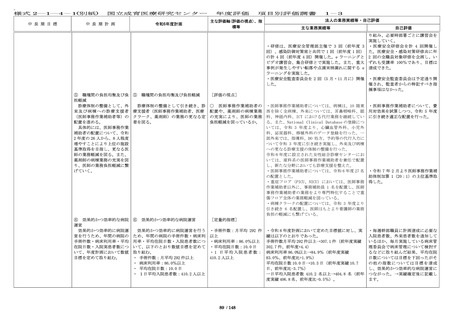
・人を対象とする生命科学・医学系
研究に関する倫理指針にもとづく研
究、臨床研究法にもとづく研究、治
験を行う場合のそれぞれについて、
受講すべき教育研修についてより幅
広く定め、オンラインでの受講の導
入や倫理審査システム上でのアラー
ト表示等、これらの教育研修の受講
が徹底される体制を整えて維持して
いる。
・臨床研究必須セミナーは、令和 4
年度から開始した新プログラムに
て、引き続き研修を実施している。
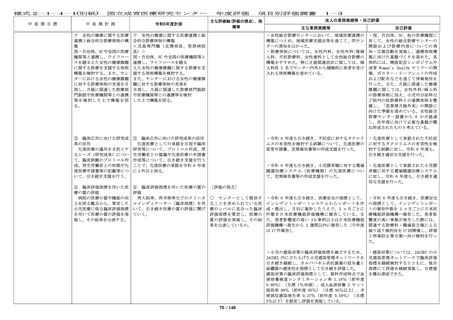
・倫理審査委員会、臨床研究審査委
員会委員対象研修を引き続き実施し
ている。
・倫理指針改訂について、臨床研究
必須セミナーのプログラムへ含めて
職員へ周知した。