【資料1-1】令和8年度研究事業実施方針(AMED研究)(案) (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59644.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第145回 7/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)これまでの研究成果の概要、及び政策等への活用又は実用化に向けた取組
国内で実用化された再生医療等技術の世界的な市場展開も視野に入れた研究支援を
行った。国際的に発信すべき細胞の安全性評価方法、製造方法や品質管理方法等の確立
が期待される。また、さらなる産学連携により、アカデミア発のシーズを速やかに企業
治験(再生医療等製品の開発)につなげる研究の増加も期待される。
【令和2年度~令和6年度までの KPI】
企業へ導出される段階に至った研究課題数:1 件
薬事承認件数(新薬、適応拡大):3 件
2 令和8年度に推進する研究課題
(1)継続研究課題のうち優先的に推進する研究課題(増額要求等する課題)の概要、及び
期待される研究成果の政策等への活用又は実用化に向けた取組
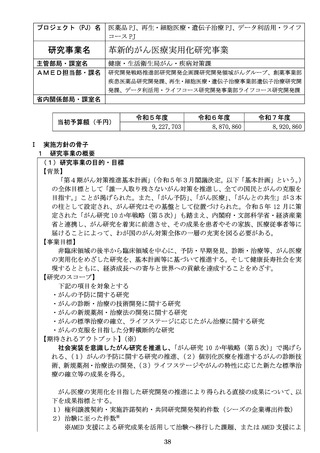
【課題名】再生医療・細胞治療・遺伝子治療用製品の産学連携による開発研究(医師主
導治験・臨床研究)
【概要】経済財政運営と改革の基本方針 2024 において、
「iPS細胞を活用した創薬や
再生医療等の研究開発の推進及び同分野に係る産業振興拠点の整備や医療安全の更
なる向上・病院の事務効率化に資する医薬品・医療機器等の製品データベースの構築
等を推進する。」とされている。そのため、アカデミアと企業との共同研究に対して支
援を行い、再生医療等製品又は再生医療に用いる医療機器としての薬事承認申請を目
指した医師主導治験・臨床研究をより一層推進する必要がある。
【成果の活用】再生医療等製品又は再生・細胞医療・遺伝子治療に用いる医療機器とし
ての薬事承認申請を目指した医師主導治験の実施を促進する。それによって、より多
くのアカデミア発のシーズが実用化されることが期待される。
(2)新規研究課題として優先的に推進する研究課題の概要、及び期待される研究成果の政
策等への活用又は実用化に向けた取組
【課題名】アカデミア発の再生医療等製品を企業の協力を得て開発する研究
【概要】アカデミア発の再生医療等製品シーズ(細胞加工物、核酸等)の速やかな実用
化のため、企業と協力し、薬事承認・事業化を見据えた開発を進める研究を支援する。
【成果の活用】再生医療等製品又は再生・細胞医療・遺伝子治療に用いる医療機器につ
いて、多くのアカデミア発のシーズが実用化されることが期待される。
Ⅱ
参考
1 研究事業と各戦略(新しい資本主義のグランドデザイン及び実行計画・フォローアップ、
成長戦略、骨太方針、統合イノベーション戦略、健康・医療戦略)との関係
【経済財政運営と改革の基本方針 2024】(令和6年6月 21 日閣議決定)
第2章 新しい資本主義に向けた改革
1.新しい資本主義に向けた重点投資分野
(1)全世代型社会保障の構築
(創薬力の強化等ヘルスケアの推進)
iPS細胞を活用した創薬や再生医療等の研究開発の推進及び同分野に係る産業振興
32