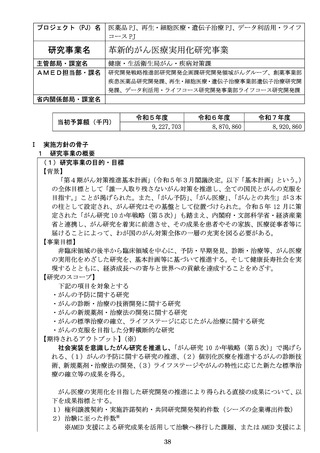
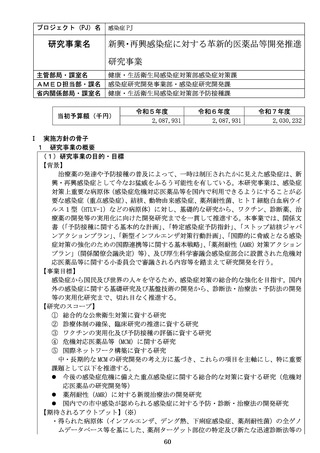
【資料1-1】令和8年度研究事業実施方針(AMED研究)(案) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59644.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第145回 7/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
・ 海外非臨床試験データ(特に GLP(Good Laboratory Practice)試験)を受け入れ
る際の生データ保存義務の合理化を検討する。
・ PMDA は、レギュラトリーサイエンスセンターと関係部門が連携し、RWD の活用や、
品目横断的な情報の統合等により、審査・相談の高度化や医薬品や医療機器の開発等に
資するガイドラインの策定等の取組を推進する。その際、国際的な規制調和の動向を適
宜反映する。
2
他の研究事業(厚生労働科学研究、AMED内、他省庁研究事業)との関係
○厚生労働科学研究
医薬品・医療機器等レギュラトリーサイエンス政策研究事業では薬事行政における
規制・取締等の見直しや制度設計、政策の立案・実行等に資する調査・研究を実施し
ている。一方、本 AMED 研究事業では、革新的医薬品等の開発に資する、各種試験系・
評価系の開発やデータ収集システム等の環境整備に関する研究を実施している。
○AMED 内研究事業
「医薬品等規制調和・評価研究事業」と「再生医療・遺伝子治療の産業化に向けた
基盤技術開発事業(再生医療技術を応用した高度な創薬支援ツール技術開発)」では
連 携 し て 、 医 薬 品 等 の 安 全 性 評 価 の 動 物 代 替 法 と し て 開 発 が 進 ん で い る MPS
(Microphysiological system:生体模倣システム)に関する公募を行い、試験法の国際
的な規格化・標準化や規制等への活用に向けた研究を実施している。
17