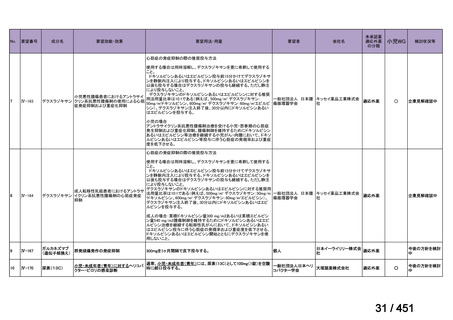
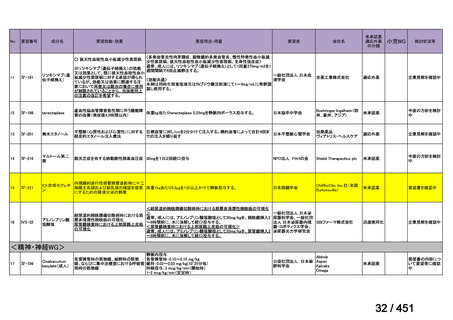
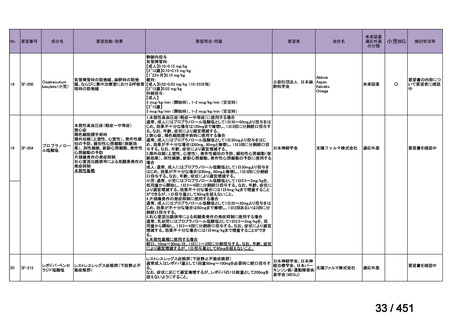
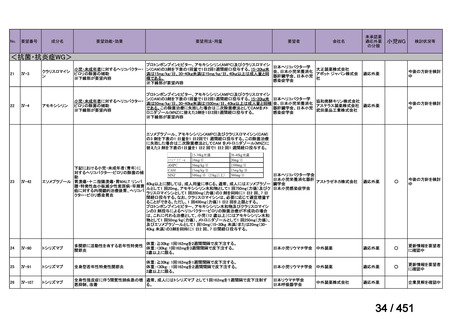
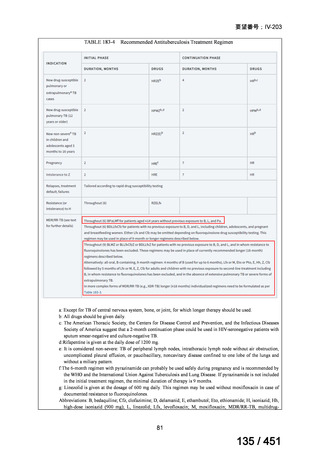
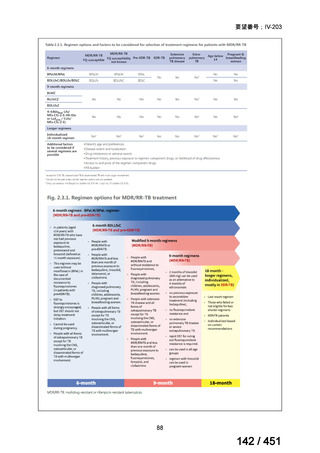
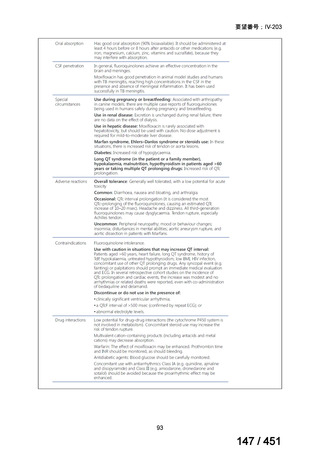
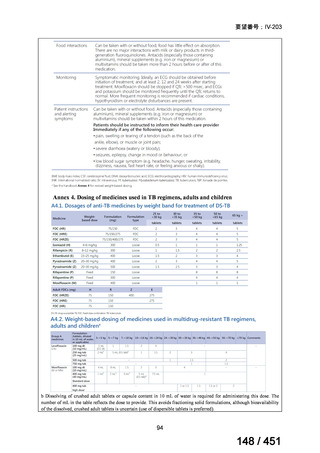
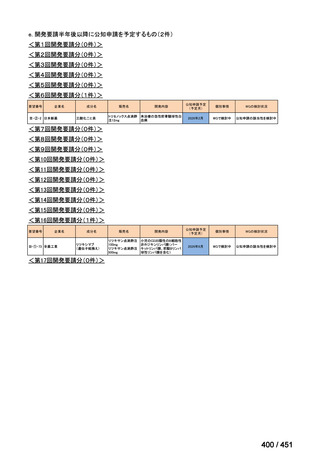
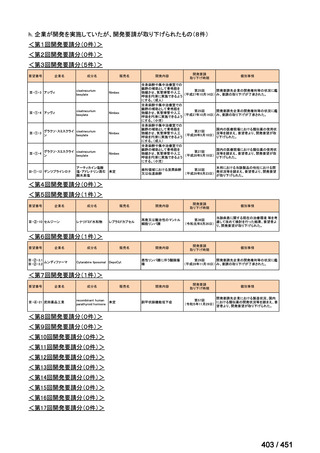
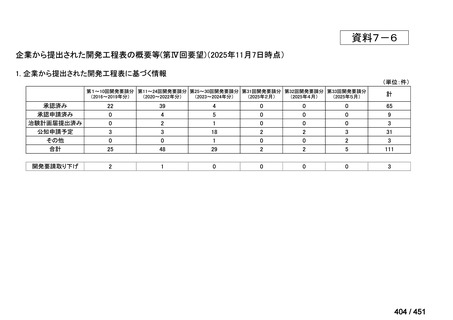
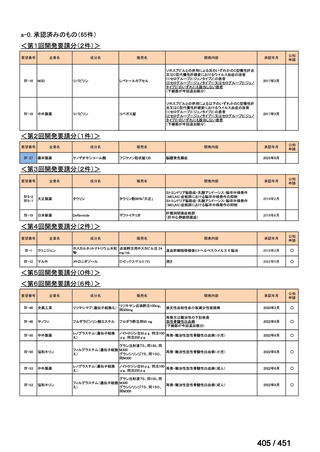
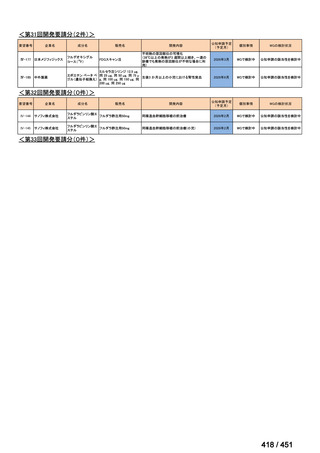
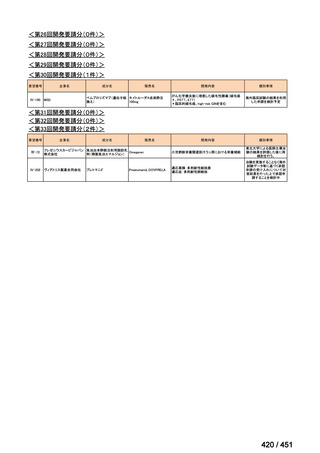
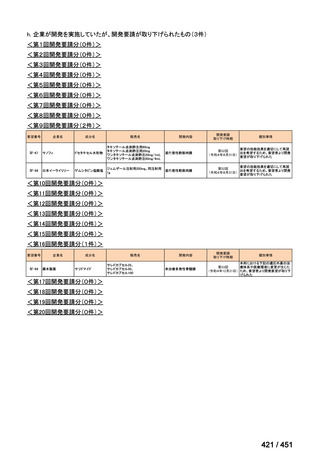
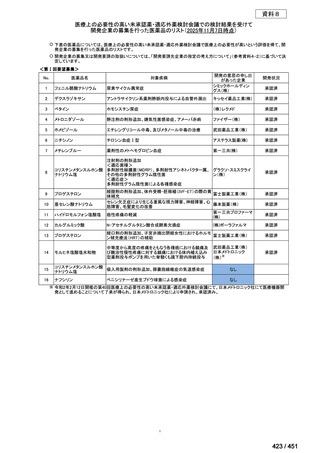
会議資料 (96 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
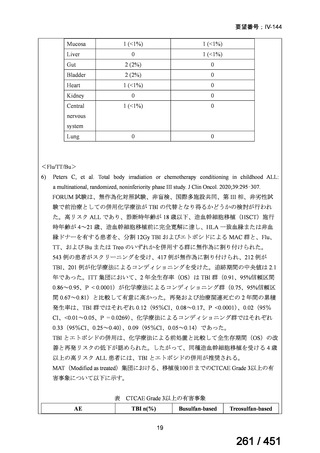
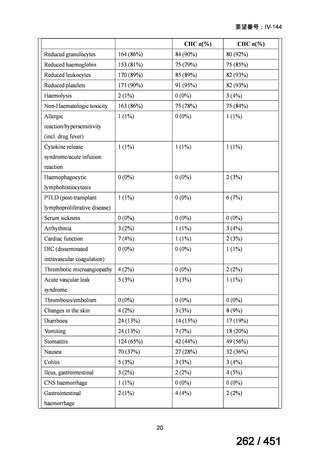
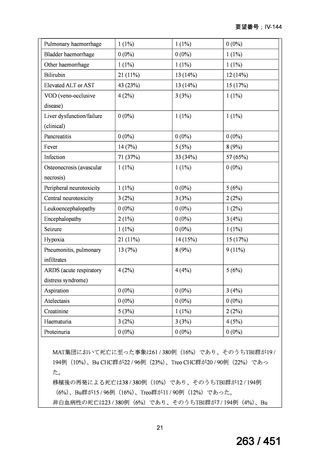
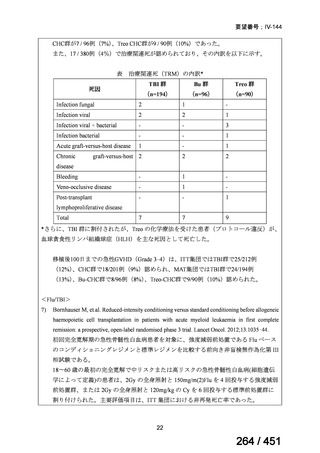
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
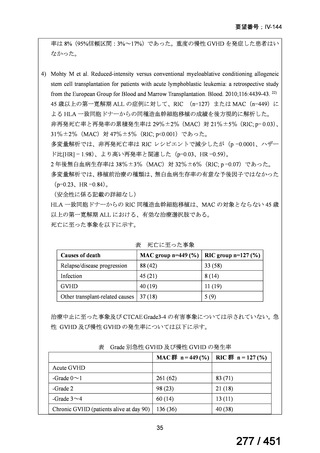
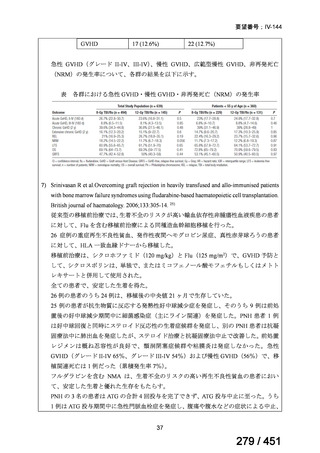
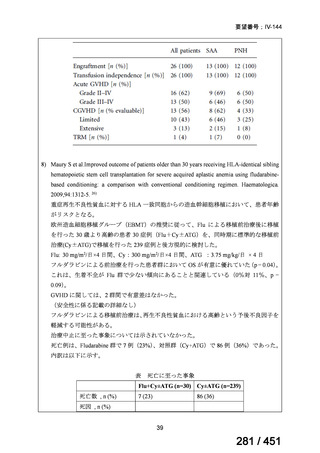
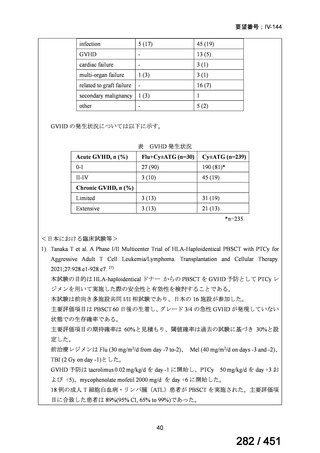
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
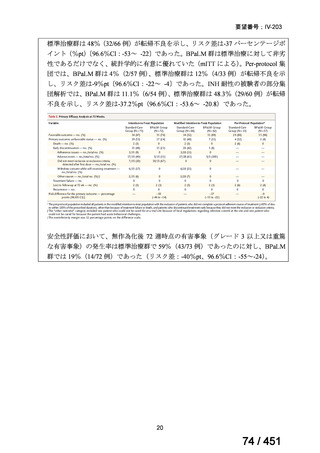
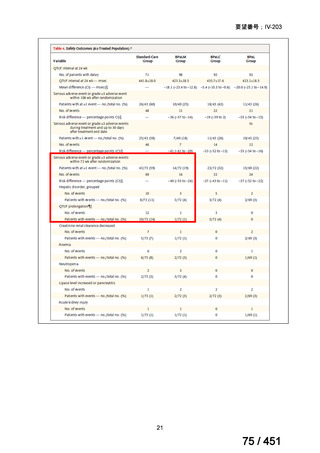
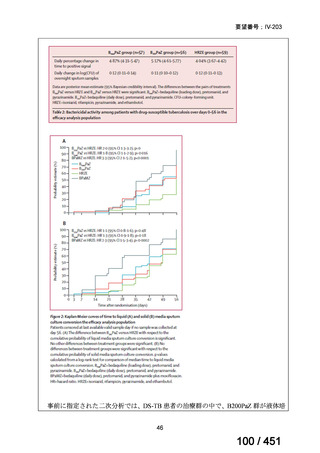
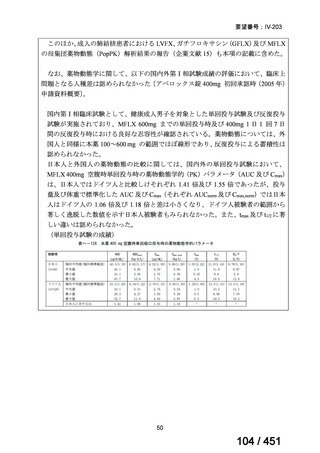
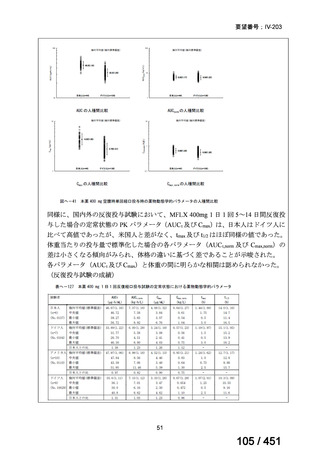
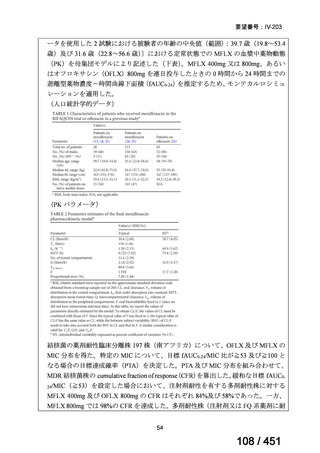
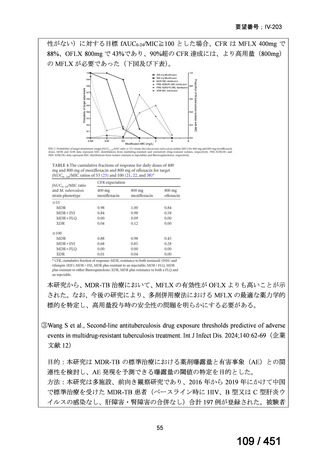
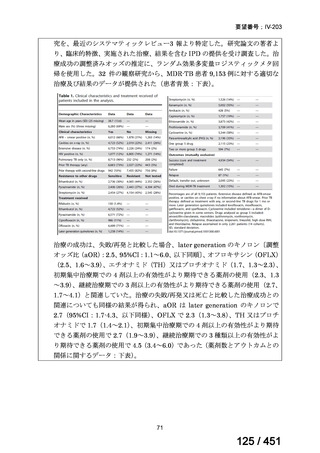
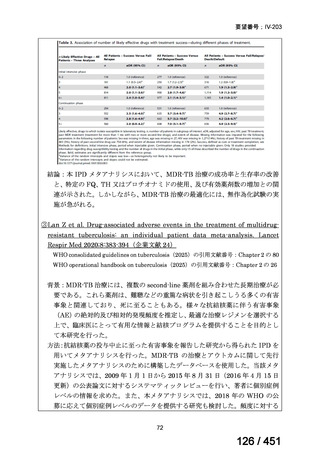
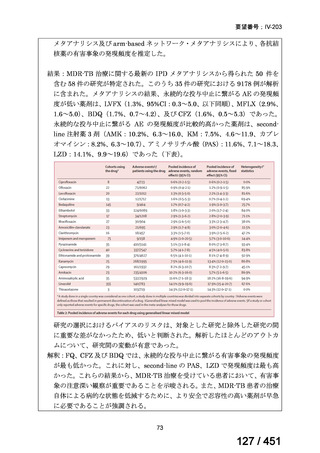
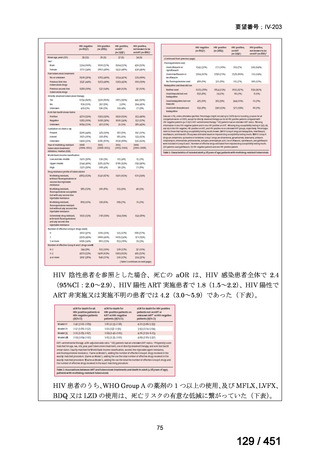
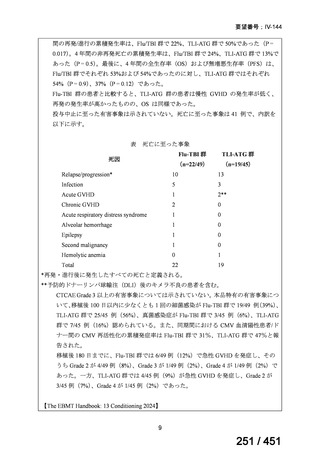
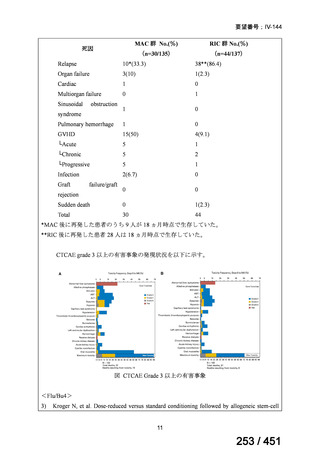
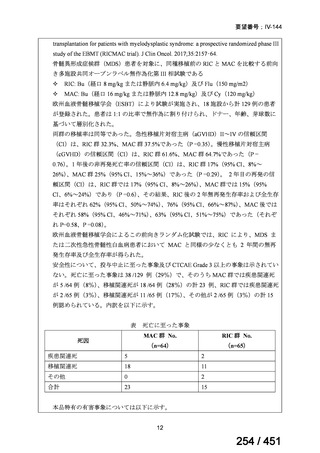
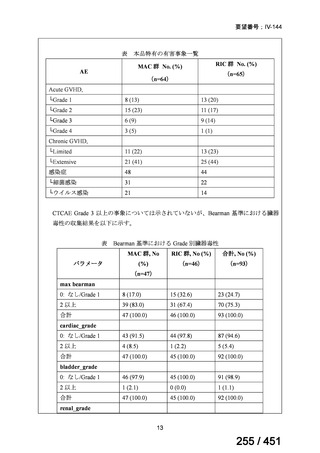
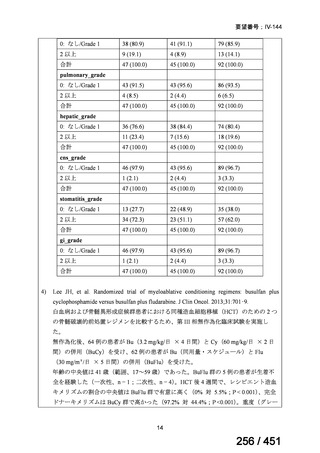
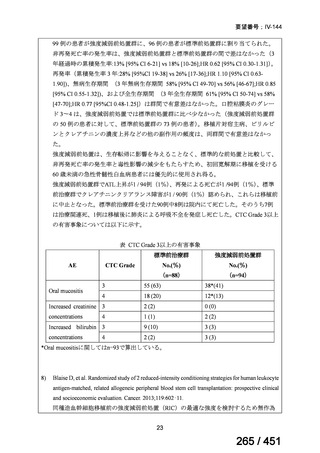
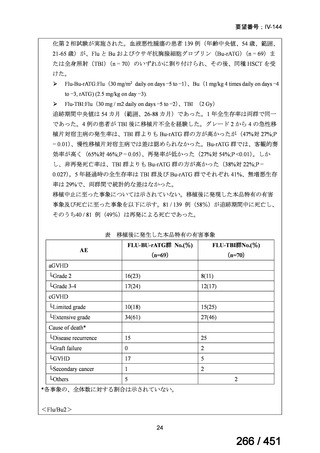
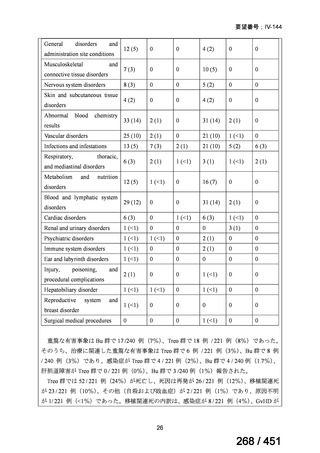
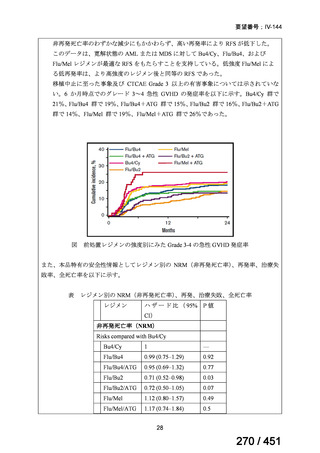
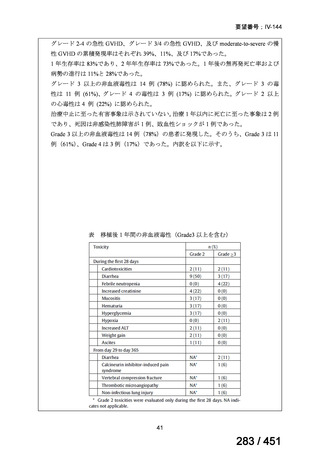
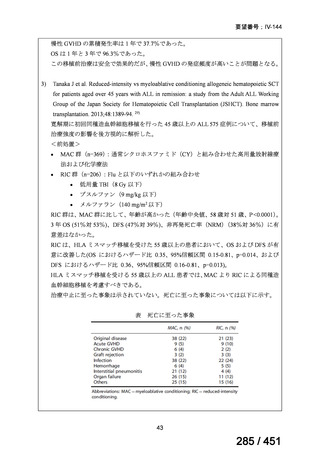
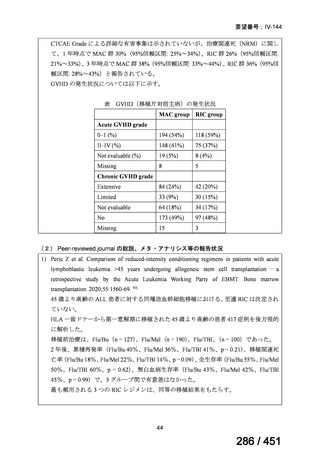
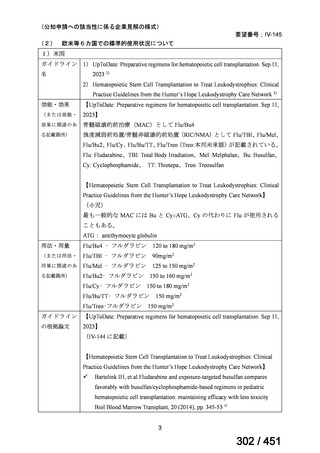
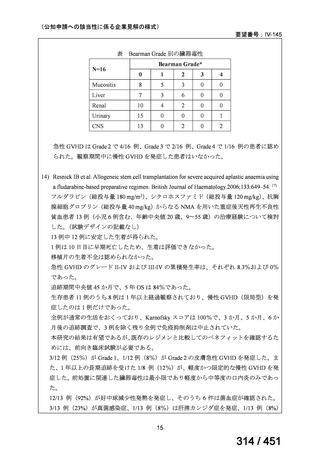
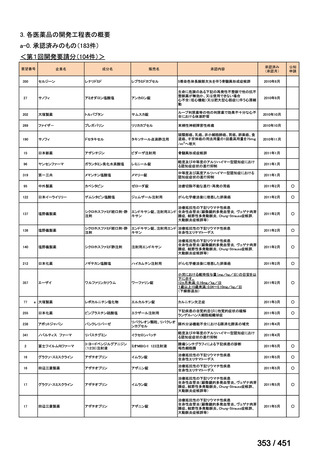
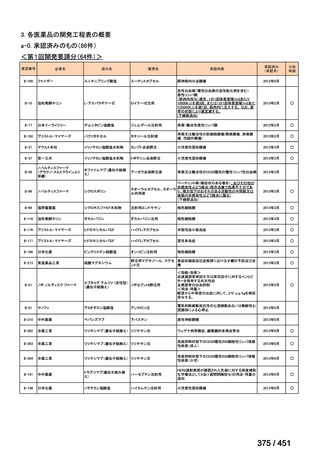
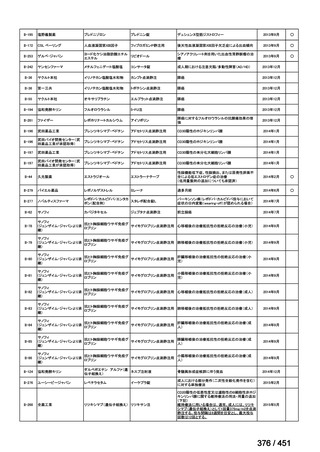
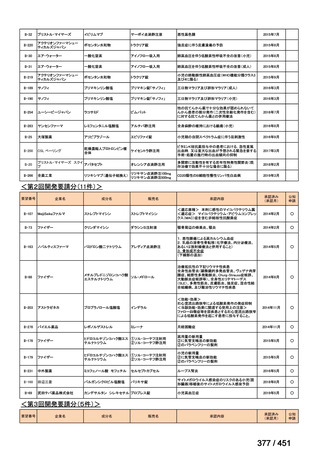
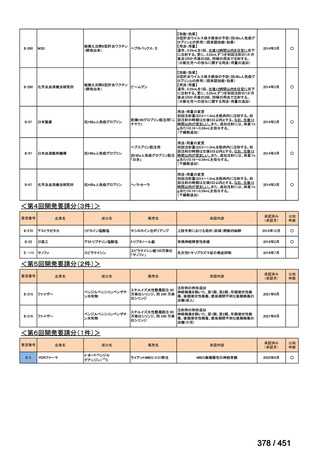
有害事象の頻度はすべての群で標準治療と同様であった。最も一般的な有害事象は
高尿酸血症で、59 例(29%)でみとめられた〔(MPa100Z 群 17 例(28%)、MPa200Z
群 17 例(27%)、HRZE 群 17 例(29%)、DRMPa200Z 群 8 例(31%)〕。他の一般的
な有害事象は、悪心〔MPa100Z 群 14 例(23%)、MPa200Z 群 8 例(13%)、HRZE
群 7 例(12%)、DRMPa200Z 群 8 例(31%)〕や、嘔吐〔MPa100Z 群 7 例(12%)、
MPa200Z 群 7 例(11%)、HRZE 群 7 例(12%)、DRMPa200Z 群 4 例(15%)〕であ
った。治療中の心電図で QT 間隔が 500ms を超える事例(心室性頻脈性不整脈の潜
在的な指標)は報告されなかった。レジメン内の薬剤に対して、表現型耐性に至っ
たものはなかった。
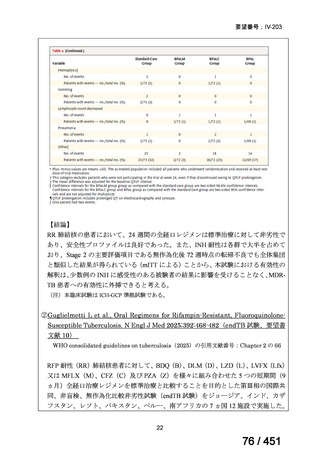
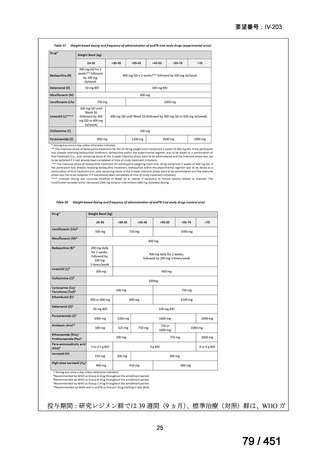
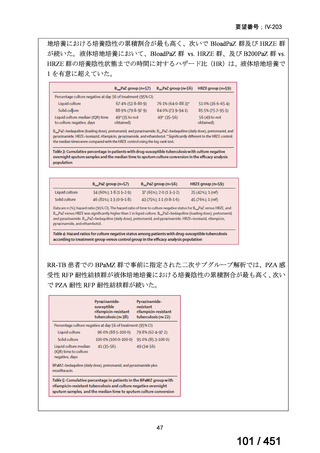
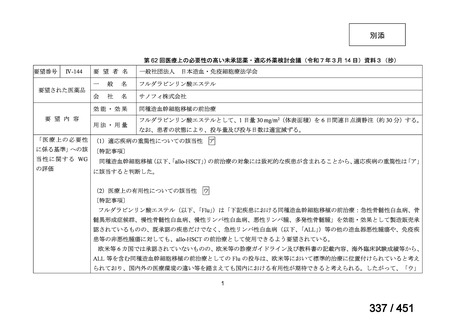
【解釈】
MFLX、プレトマニド及び PZA の組み合わせは、安全で耐容性が高く、8 週間の治
療中に DS-TB において優れた殺菌活性を示した。結果は DS-TB と MDR-TB の間で
一貫していた。この新しいレジメンは治療の短縮と簡素化を目指して、DS-TB 及び
MDR-TB 患者を対象とした第Ⅲ相試験への準備が整っている。
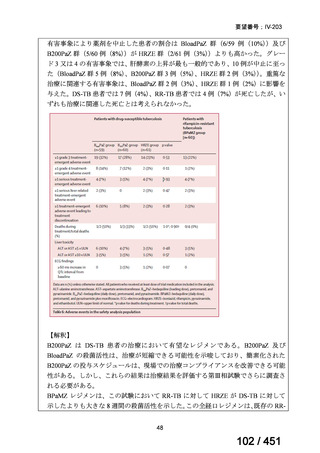
(注)本臨床試験は GCP 準拠試験である。
⑥ Tweed CD et al., Bedaquiline, moxifloxacin, pretomanid, and pyrazinamide
during the first 8 weeks of treatment of patients with drug-susceptible or drugresistant
pulmonary
tuberculosis:
a
multicentre,
open-label,
partially
randomised, phase 2b trial. Lancet Respir Med. 2019;7:1048-1058(要望書文献
9)
42
96 / 451