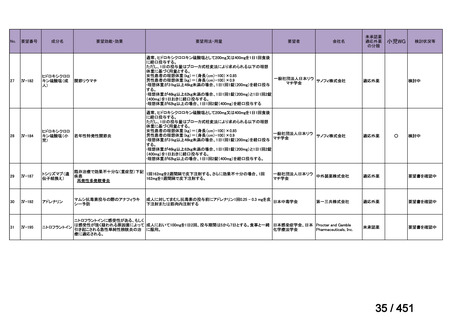
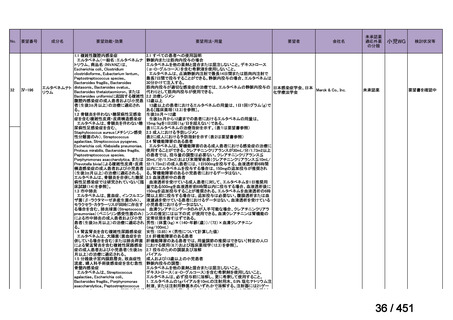
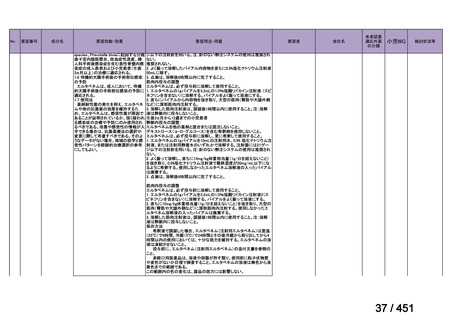
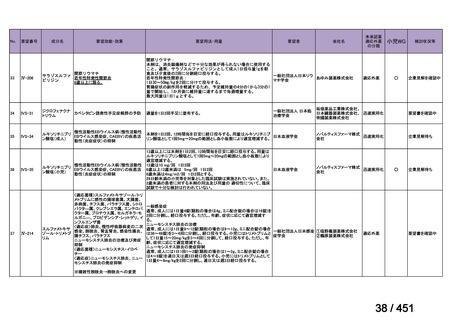
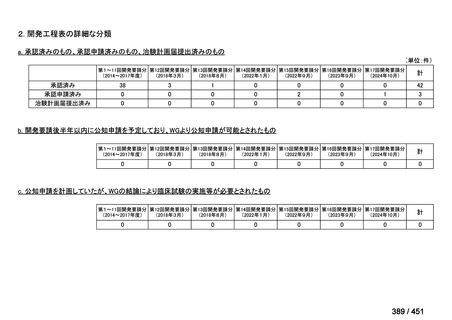
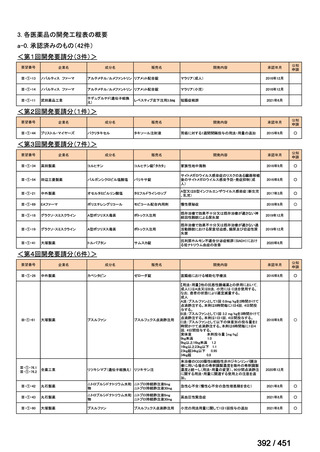
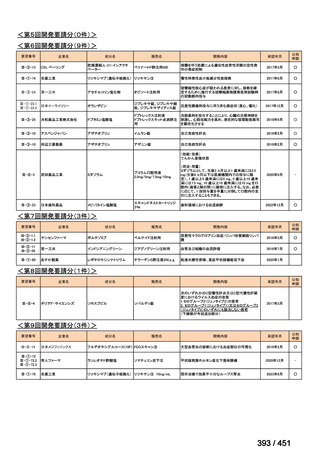
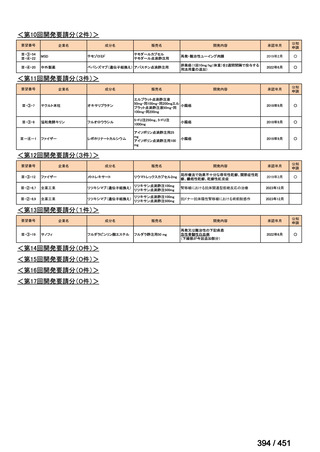
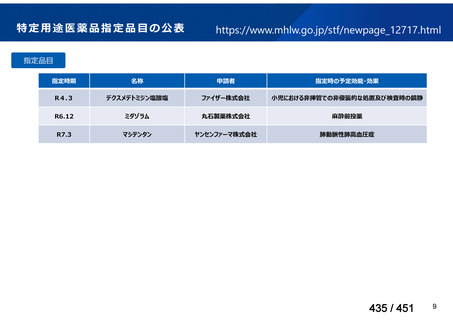
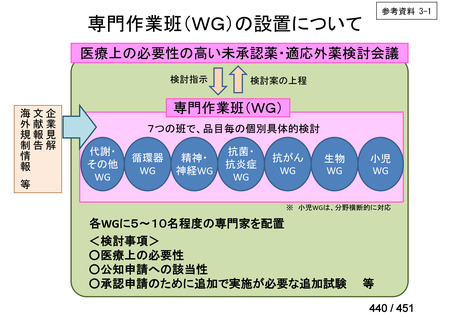
会議資料 (250 ページ)
出典
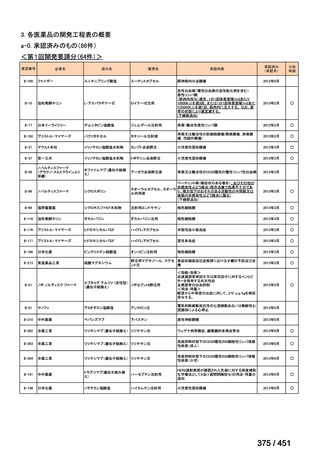
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
備考
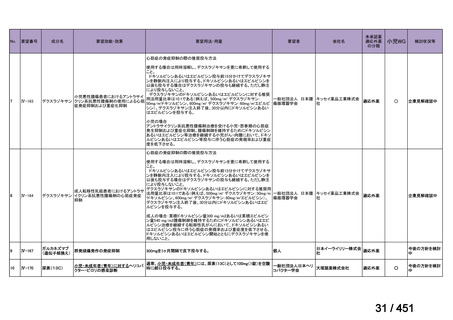
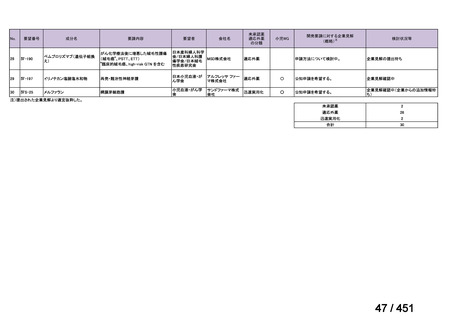
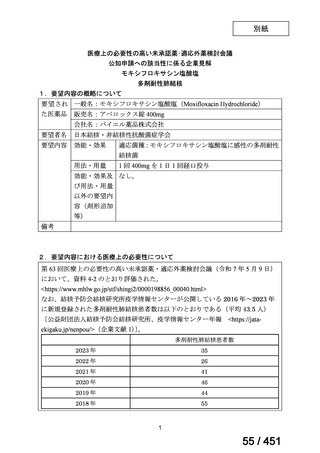
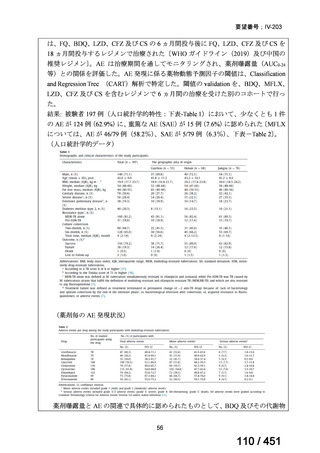
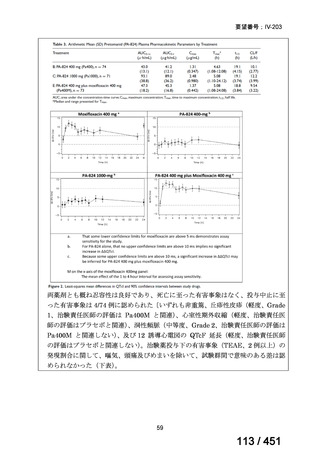
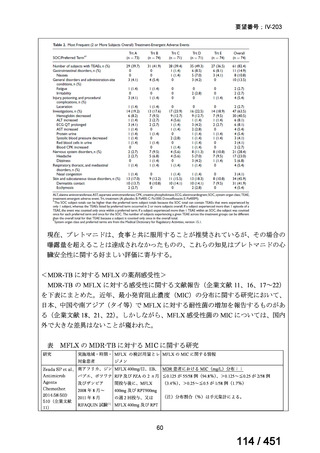
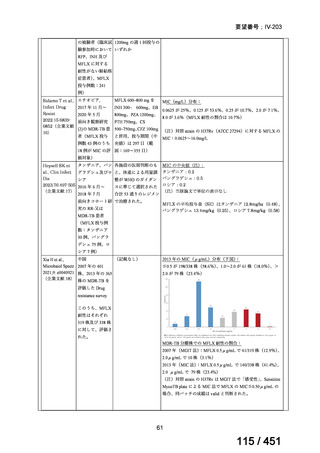
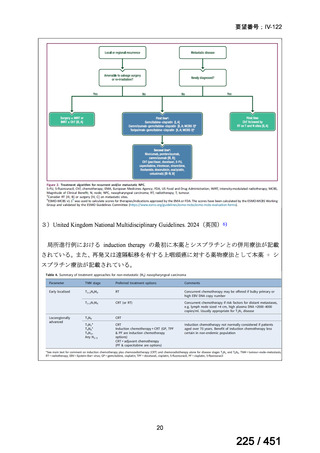
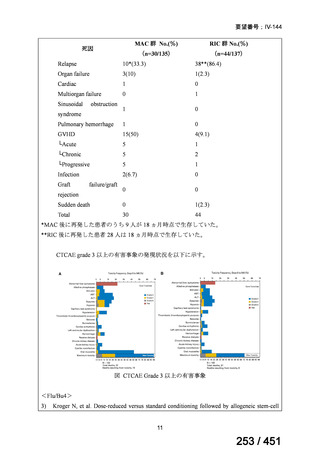
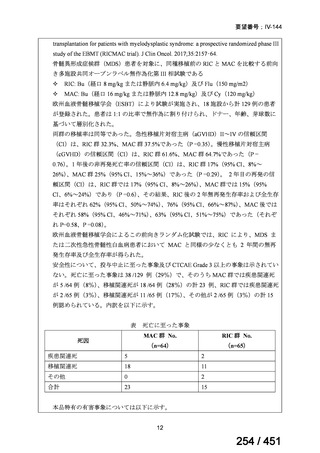
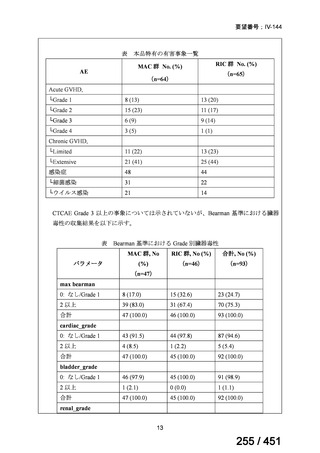
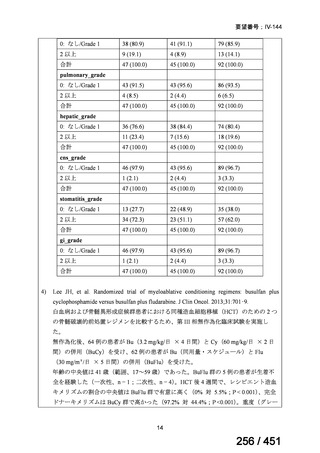
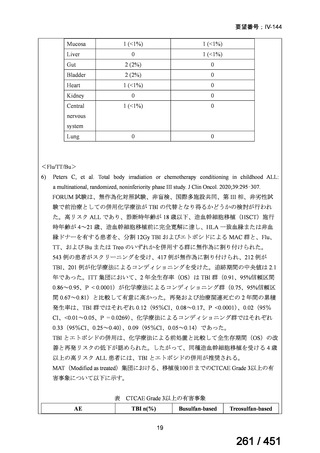
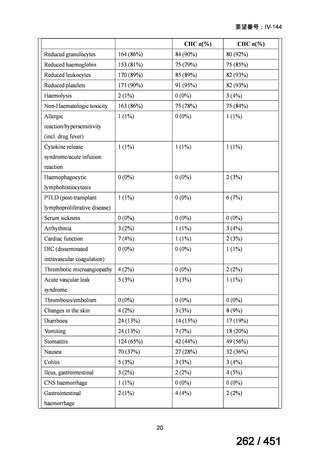
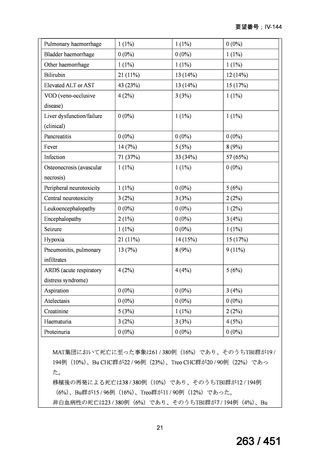
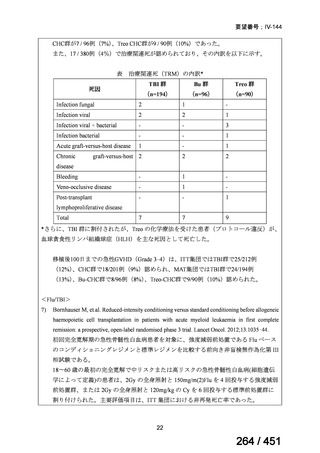
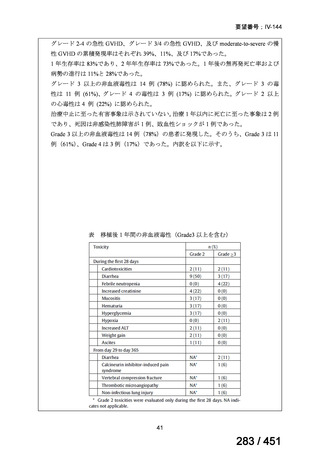
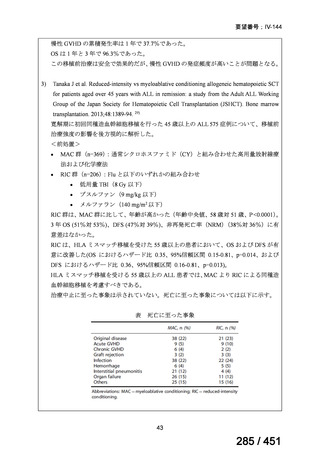
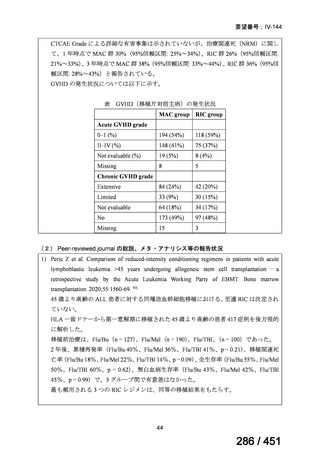
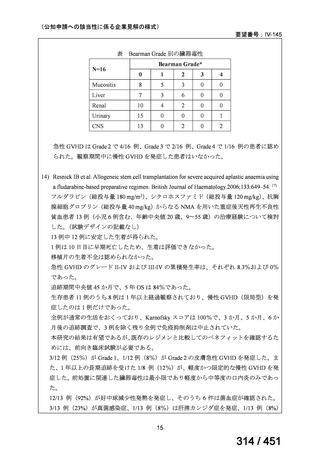
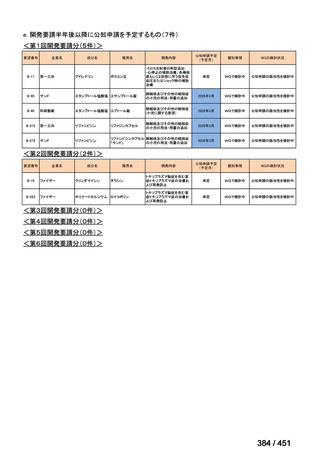
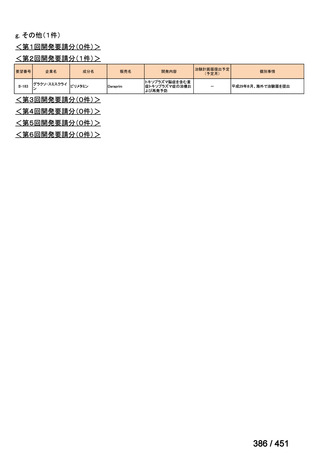
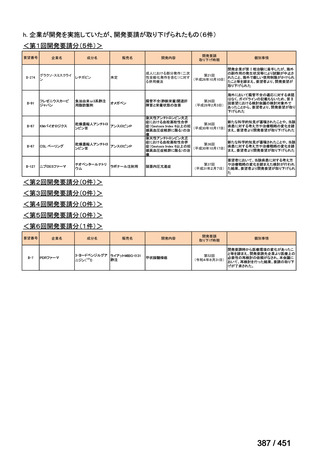
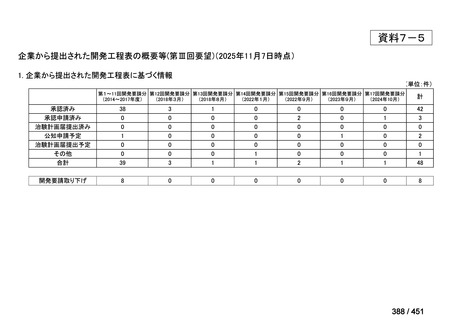
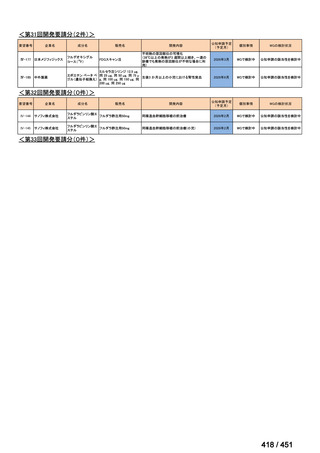
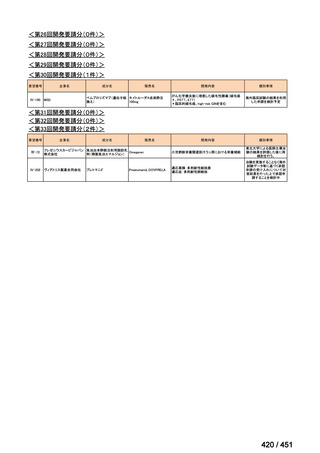
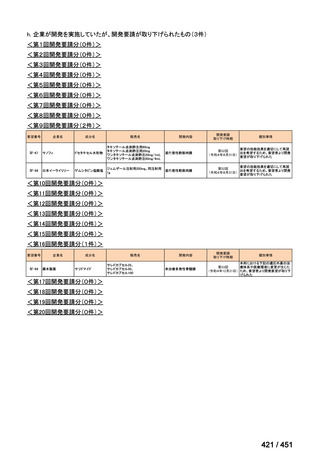
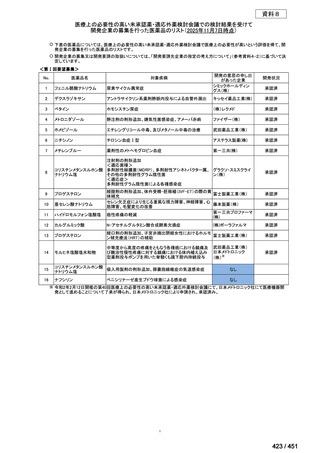
4.要望内容について企業側で実施した海外臨床試験成績について
なし
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
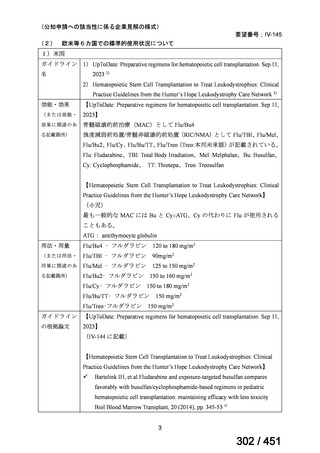
米国のガイドライン、UpToDate: Preparative regimens for hematopoietic cell transplantation. Sep
11, 2023 及欧州のガイドライン、The EBMT Handbook: 13 Conditioning 2024 におけるフルダ
ラビン(以下、Flu)に関連するレジメンの根拠論文の要約を以下に記載する。Treo 及び
Amsacrine が本邦で未承認のため、Flu/Treo 及び FLAMSA のレジメンに関する論文は除い
た。
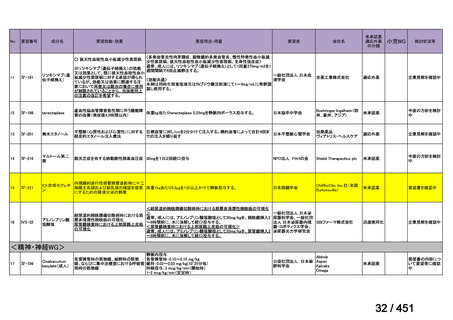
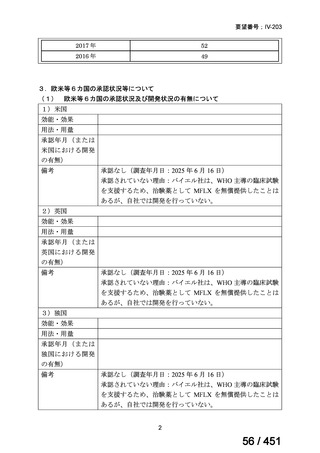
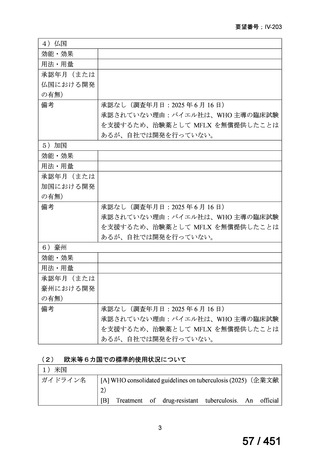
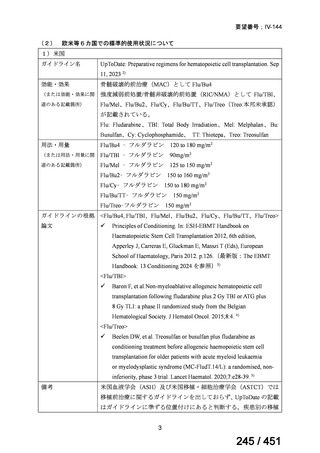
【UpToDate: Preparative regimens for hematopoietic cell transplantation. Sep 11, 2023】
<Flu/TBI>
1)
Baron F, et al.Non-myeloablative allogeneic hematopoietic cell transplantation following
fludarabine plus 2 Gy TBI or ATG plus 8 Gy TLI: a phase II randomized study from the
Belgian Hematological Society. J Hematol Oncol. 2015;8:4.
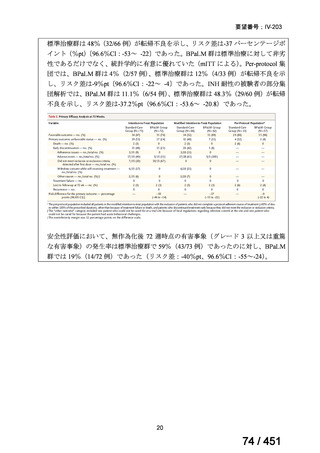
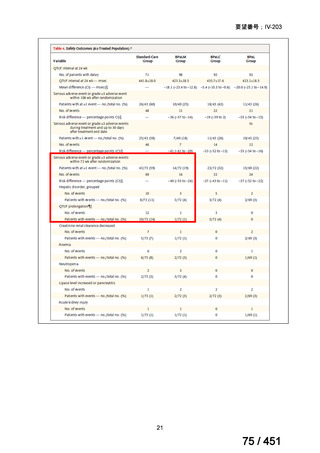
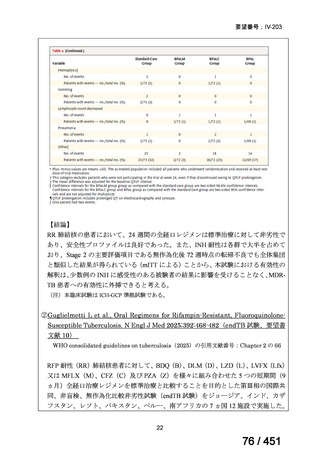
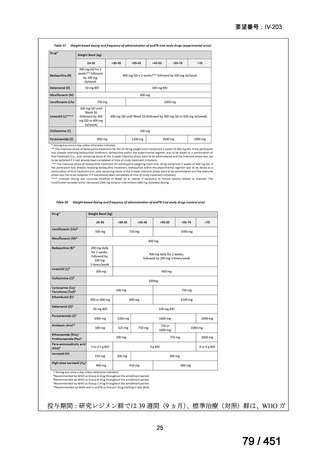
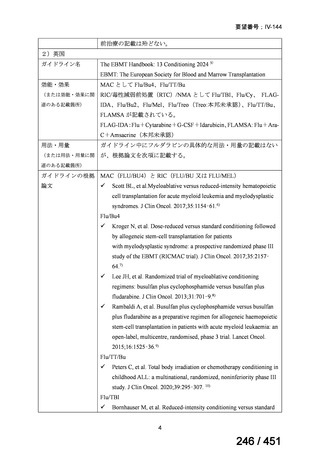
組織学的に確認された造血悪性腫瘍の 75 歳以下の患者を対象に、HLA 一致同胞(n =
54)または HLA 一致非血縁ドナー10/10(n = 40)からの骨髄非破壊的同種造血幹細胞移
植(NMA)を、Flu+2Gy 全身照射(Flu-TBI 群; n = 49)または 8Gy 全リンパ節照射+抗
胸腺細胞グロブリン(TLI-ATG 群; n = 45)の前処置と比較した第 II 相多施設ランダム化
試験である。
Flu-TBI : Flu 30 mg / m2 で-4、-3、および -2 日目に投与し、続いて 0 日目に 2
Gy TBI (-1 日目の TBI 投与も許容)。
TLI-ATG: 8 Gy の胸腺リンパ節照射(TLI)(移植 11 日前から開始し、1 日 80 cGy
を合計 10 回(8 Gy)投与)と、ATG(Thymoglobulin)を-11 日目から-7 日目まで
1.5 mg/kg/日の用量で静脈内投与
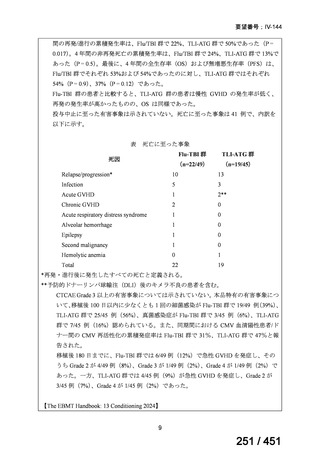
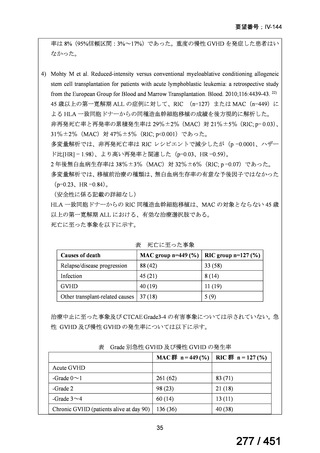
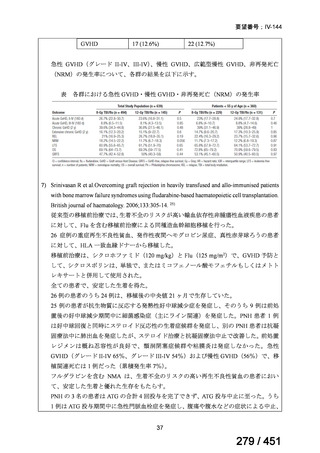
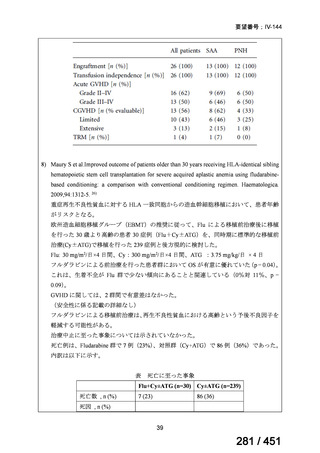
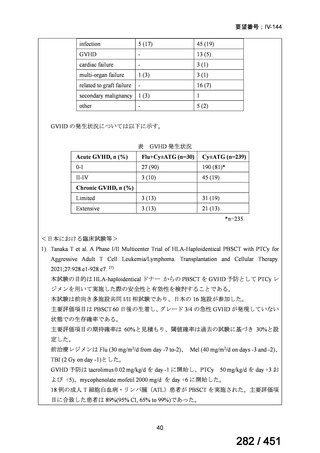
グレード II~IV 急性 GVHD(主要評価項目)の 180 日間累積発生率は、Flu/TBI 患者
で 12.2%、TLI-ATG 患者で 8.9%であった(P = 0.5)。中等度/重度の慢性 GVHD の 2 年
間累積発生率は、Flu-TBI 患者で 40.8%、TLI-ATG 患者で 17.8%であった(P =
0.017)。5 例の Flu-TBI 患者と 10 例の TLI-ATG 患者は、ドナーキメリズムレベルが低
いため、予防的なドナーリンパ球輸注(DLI)を事前に投与を受けた。一方、1 例の
Flu-TBI 患者と 5 例の TLI-ATG 患者(予防的な DLI を受けた 2 例を含む)は、移植片
機能不良、移植片拒絶反応、または疾患進行のため、2 回目の HCT を受けた。 4 年
8
250 / 451