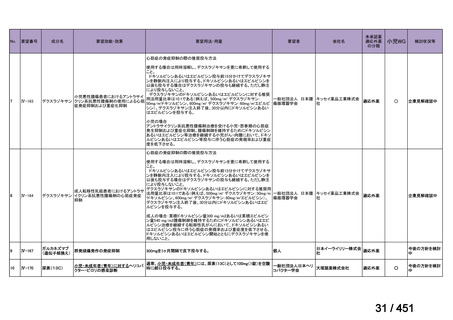
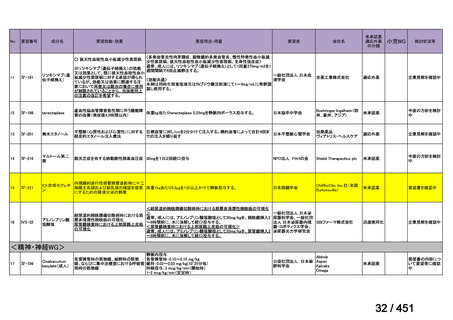
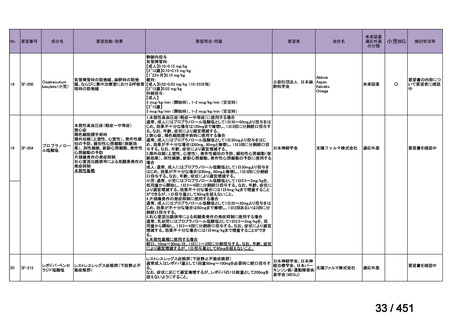
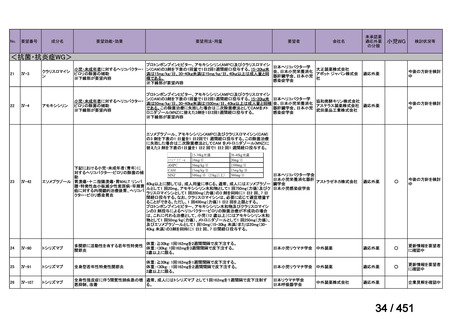
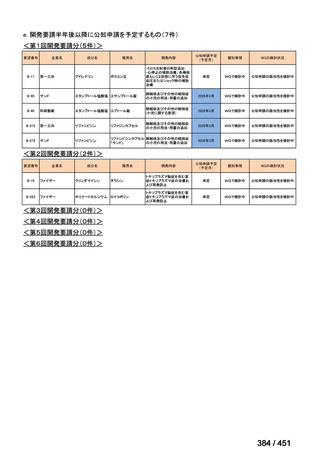
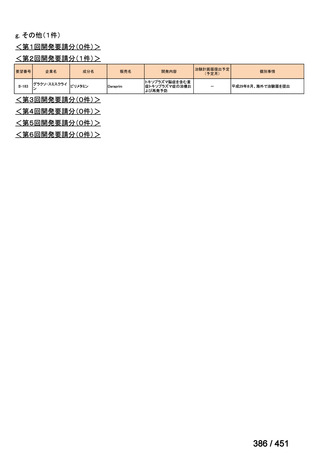
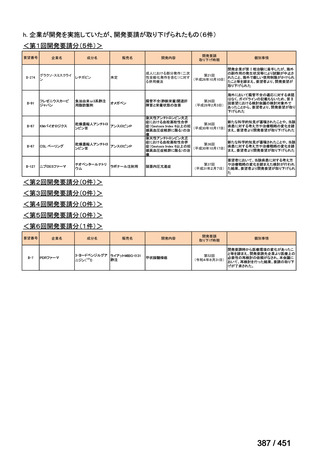
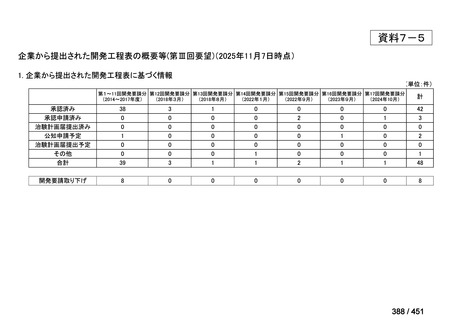
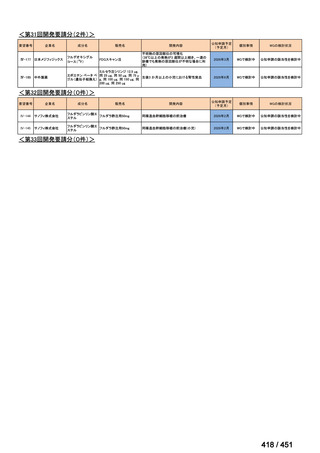
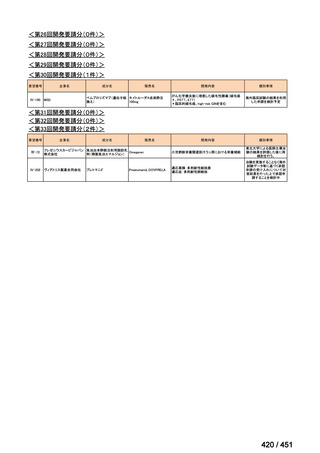
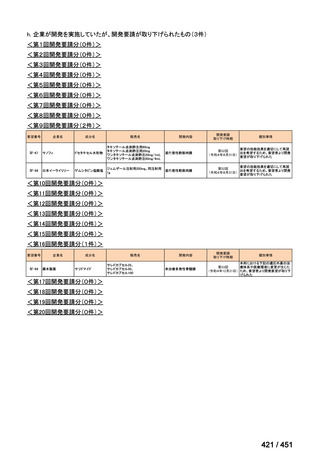
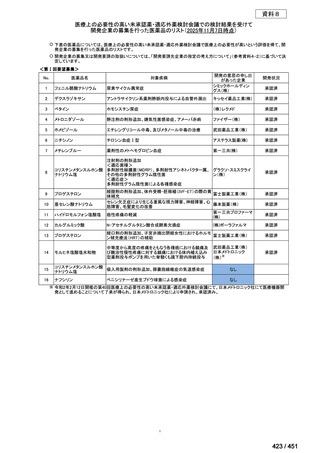
会議資料 (191 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
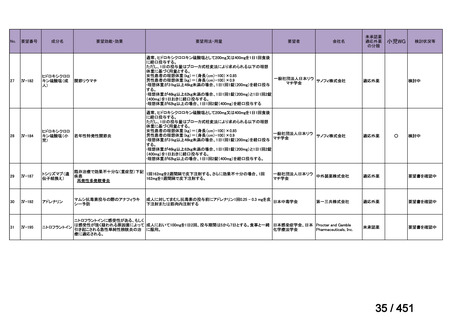
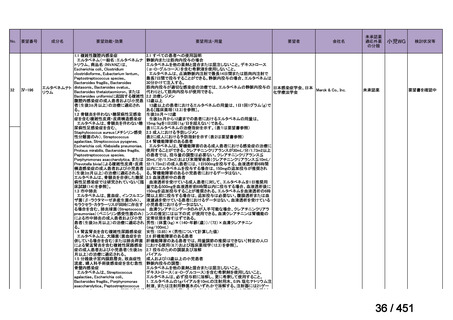
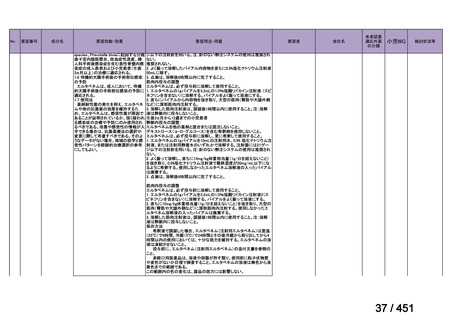
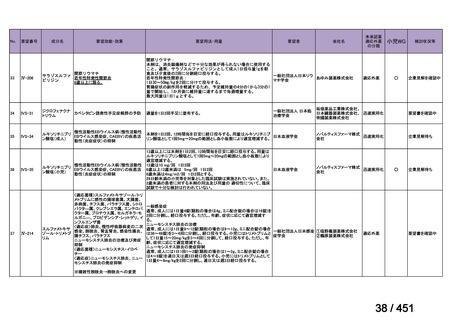
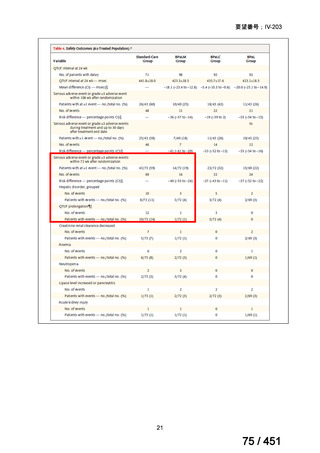
験は実施されておらず、安全性は確立されていないことから、禁忌とされている。
また、妊婦又は妊娠している可能性のある女性に対しても、動物実験(サル、経口)
で流産が報告されていることから、禁忌とされている。
国内外文献の記載からは、小児、妊婦又は妊娠している可能性のある女性の多剤
耐性肺結核症に対する適切な用法・用量の設定に繋がる情報は得られておらず、今
回の申請には小児、並びに、妊婦又は妊娠している可能性のある女性の用法・用量
を含めないこととする。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評
価について
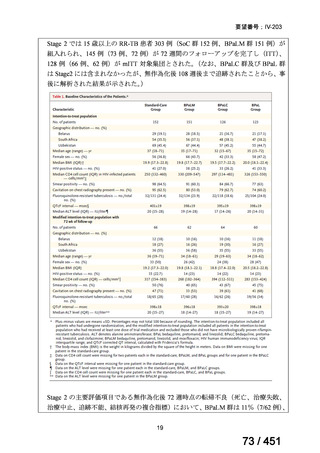
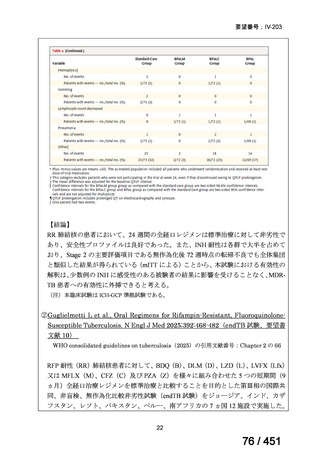
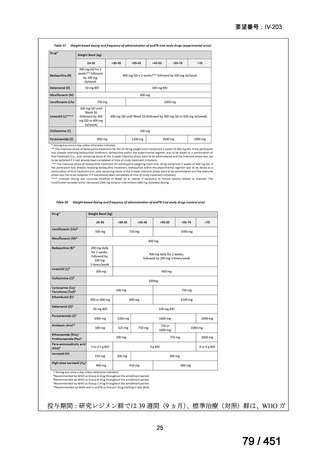
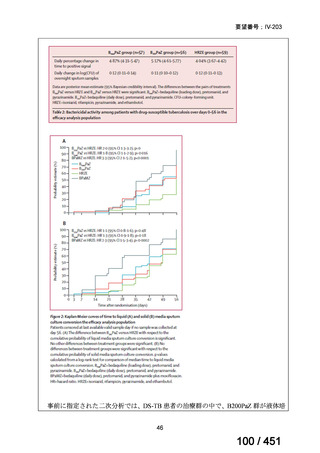
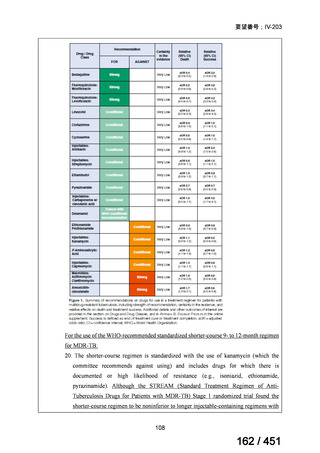
1. 用法・用量、投与期間と安全性について
多剤耐性結核症の治療について、成書やガイドラインで推奨されるレジメンで
は、体重によらず、原則、400mg 1 日 1 回投与とされている。これは、本剤ですで
に承認されている適応症における用法・用量と同様である。
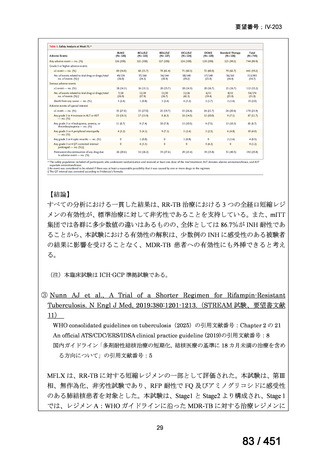
なお、MFLX の用量については、成人で 600~800mg/日の高用量投与による有効
性が高まることが AUC0-24/MIC 比に基づく検討で示唆されたとの報告が幾つかあり
(企業文献 11、14、15 及び 16)、9 ヵ月短縮レジメンを検討した STREAM 試験(要
望書文献 11)では高用量の MFLX(体重 33kg 未満に 400mg、33~50kg に 600mg、
50kg 超に 800mg)が使用されている。WHO ハンドブック(2025)でも体重に応じ
て 600~800mg の高用量が選択肢となることが示されている(企業文献 4)。しかし
ながら、9 ヵ月短縮レジメンを支持するエビデンスである南アフリカの後ろ向き観
察研究(企業文献 5)における MFLX の用量は、MFLX が 10~15mg/kg/日、最大用
量 400mg であったこと、6 ヵ月 BPaLM レジメンを検討した TB-PRACTECAL 試験
(要望書文献 7)及び 9 ヵ月 BLMZ レジメンを検討した endTB 試験(要望書文献
10)では体重によらず 400mg/日の用量が使用され、いずれの試験においても標準治
療に劣ることのない有効性と良好な安全性が示されている。
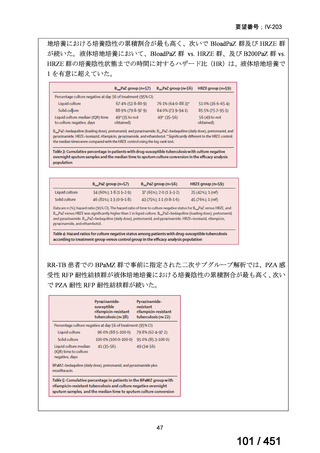
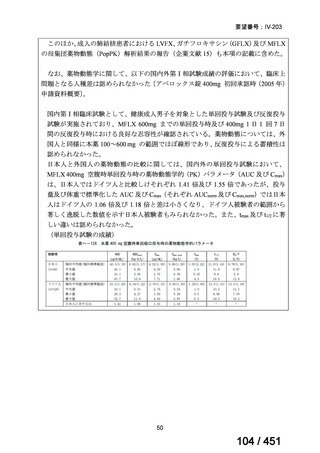
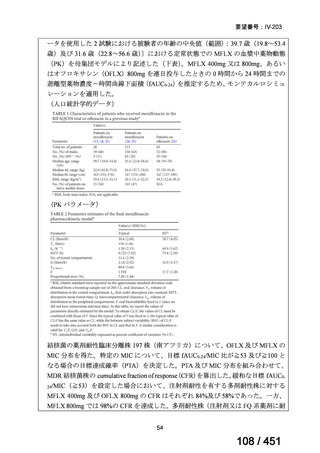
一方で、MFLX について懸念される QTc 延長に係る中国人 MDR-TB 患者の AUC024 での閾値が 49.3 mg・h/L であったという報告(企業文献 12)があり、国内第Ⅰ相
反復投与試験において MFLX 400mg 1 日 1 回 5~14 日投与後の AUCτ〔幾何平均
(標準偏差)〕が 46.67 mg・h/L(1.16)であったことを踏まえると、日本人で 400mg/
日を超える用量の MFLX を敢えて投与する必要性は乏しいと考えられる。
バイエルでは、規制要件に従って市販製品であるアベロックス(MFLX)の安全
性監視活動を行っている。適応外である結核症への投与状況は確認できないもの
の、有害事象報告は集積している。
2. 併用薬と安全性について
成書及び国内外の治療ガイドラインが示すように、多剤耐性肺結核症に対する治
137
191 / 451