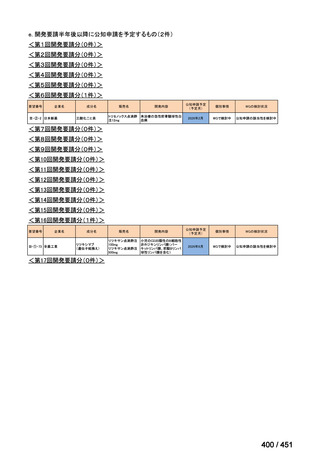
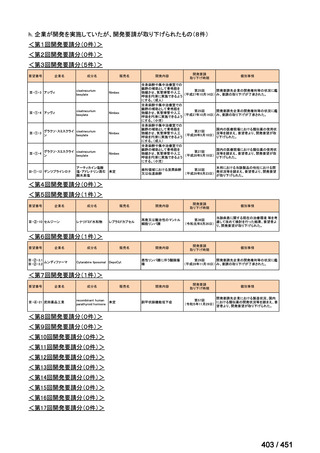
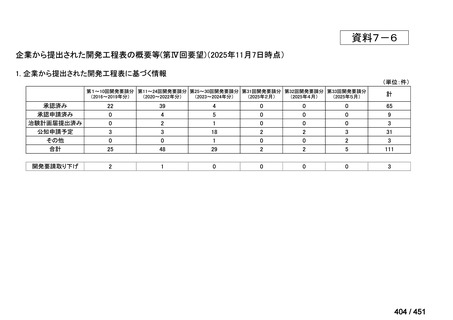
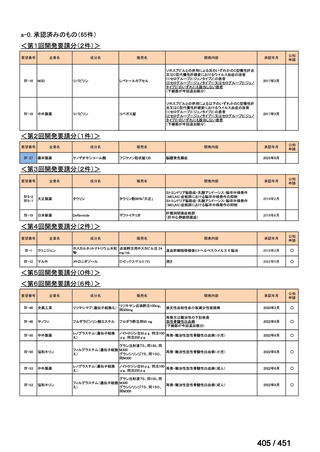
会議資料 (188 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
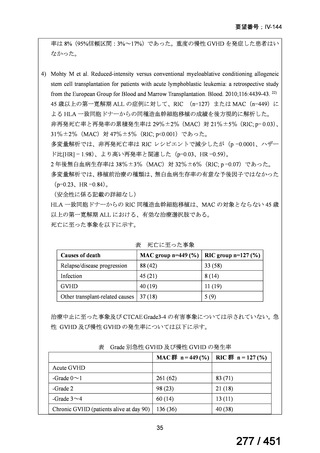
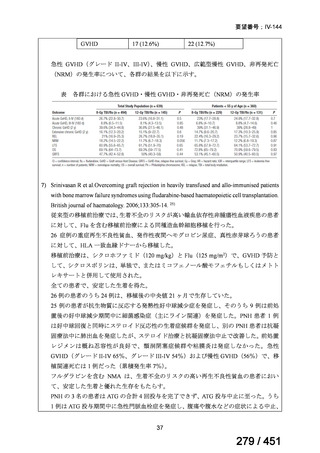
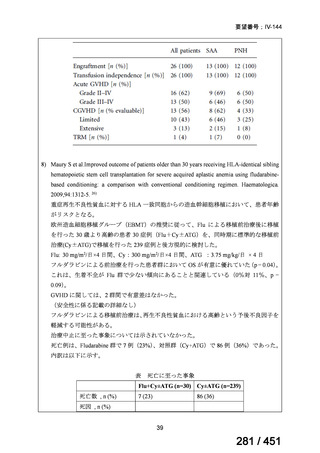
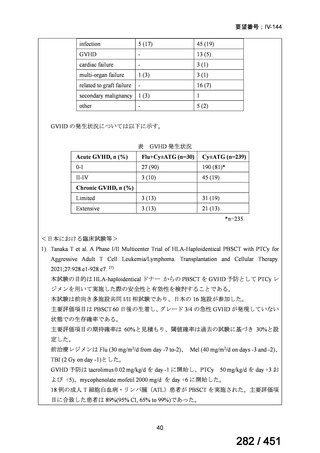
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
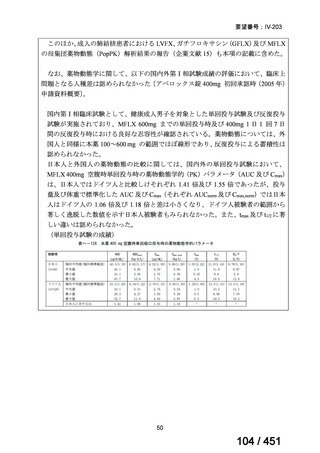
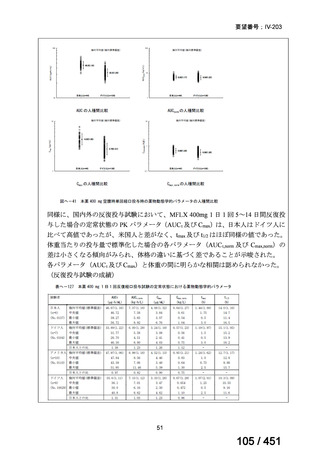
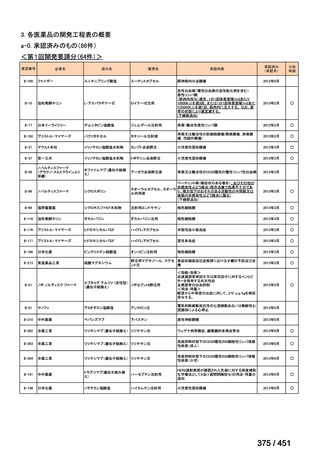
PZA は日本国内の結核診療ガイドライン(要望書文献 12)で推奨される用法・用量
とほぼ同じである。LZD は、MDR-TB に対する効能・効果では未承認であるが、
MDR-TB の成人における 1 日 1 回 600mg の用法・用量での使用は保険償還の対象
となる。したがって、MFLX が承認されれば、本レジメンが国内の実臨床で使用で
きると考える。
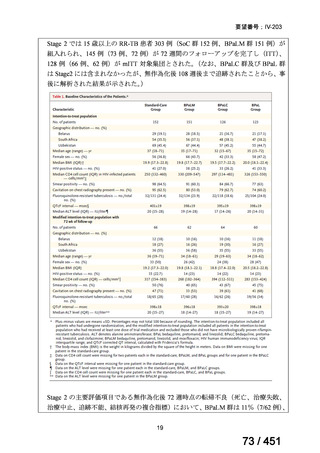
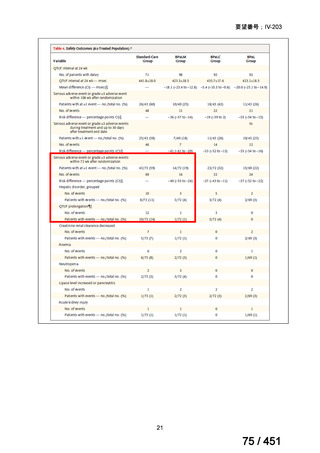
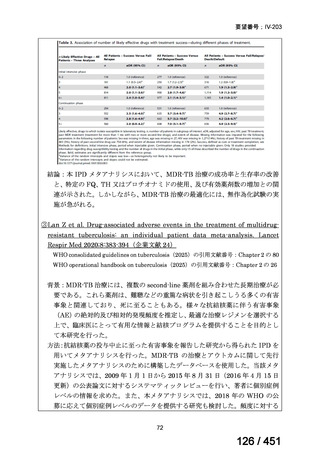
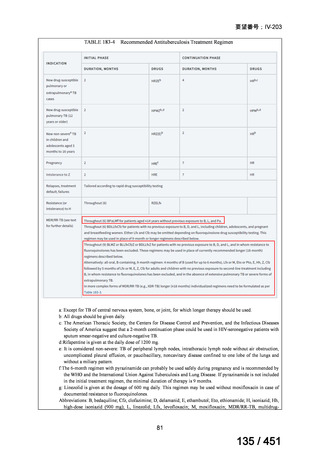
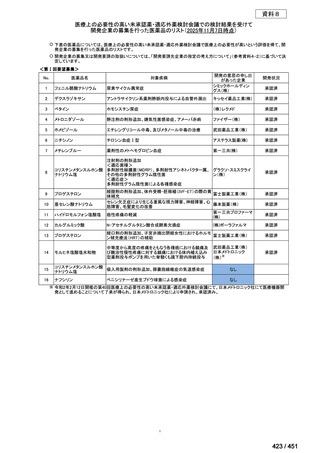
薬剤
WHO の用法・用量
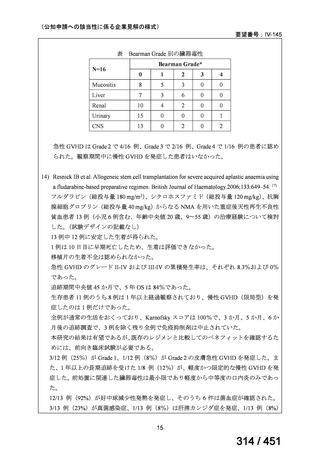
ベダキリン
1 日 400mg を 2 週間、その後 200mg 週 3 回
リネゾリド
600mg 1 日 1 回を 16 週間、その後 300mg 1 日 1 回、又は
600mg 1 日 1 回を 16 週間、その後 600mg を週 3 回
モキシフロキサシン
400mg 1 日 1 回
ピラジナミド
20–30 mg/kg/day. 最大 1 日量 2000 mg
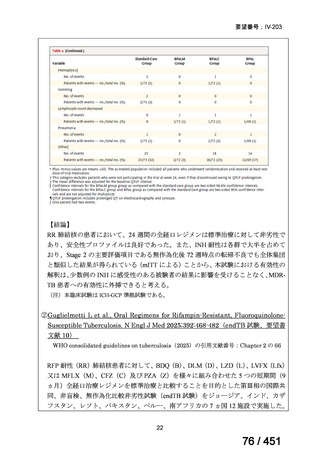
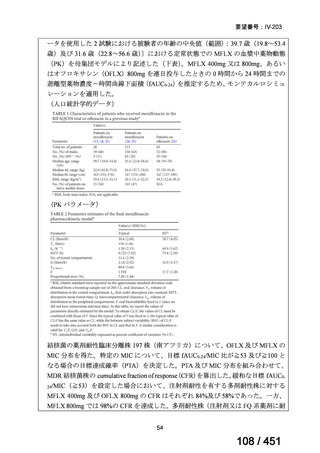
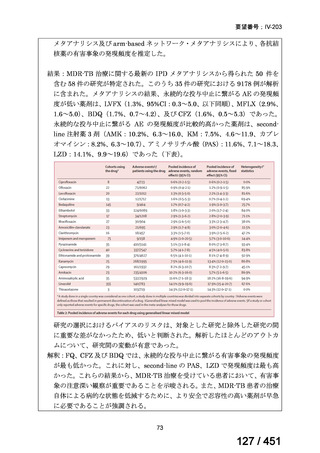
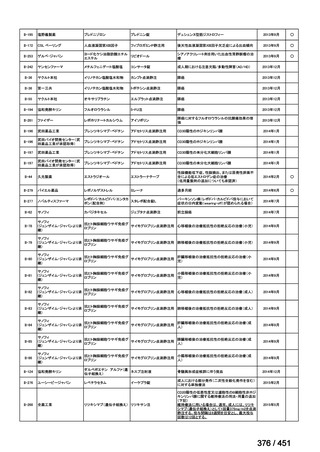
BLMZ レジメンの主な適格基準
WHO ハンドブック(2025)では、FQ 耐性、BDQ 又は LZD の使用歴が 1 ヵ月以
上の患者には、BLMZ レジメンは適用すべきでないとしている。「18 ヵ月未満の治
療を含める方向」における日本での適用に関する考察を参照すると、日本でもこれ
らの患者には適用しないことが望ましく、本レジメンの適格性を判断するために
FQ の薬剤感受性検査(DST)結果は早期に入手することが求められる。また、構成
薬剤について WHO では 1 ヵ月以上の使用歴がなければ BLMZ レジメンは適用で
きる(但し、耐性がないことが確認できている場合)が、日本では、通常、Secondline 抗結核薬の DST が可能な場合は実施することが求められ、構成薬剤に対する耐
性が判明すれば、レジメンは適切に中止されるものと考える。
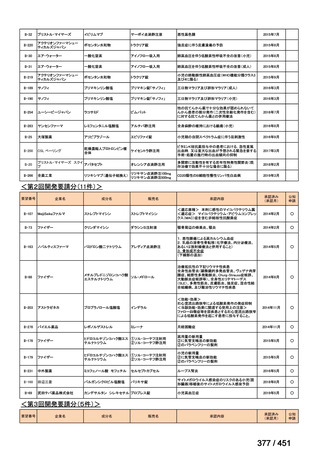
WHO の推奨では、結核の細菌学的確認や抵抗性パターンはなくとも、結核の臨
床的兆候や症状に基づき、MDR-TB 患者との接触歴 MDR/RR-TB と組み合わせて、
MDR-TB の可能性が高い小児や青年はこのレジメンを適用してよいとされている。
しかし、MFLX は小児への投与は禁忌であるため、日本国内において BMLZ レジメ
ンは小児に適用されないと考える。
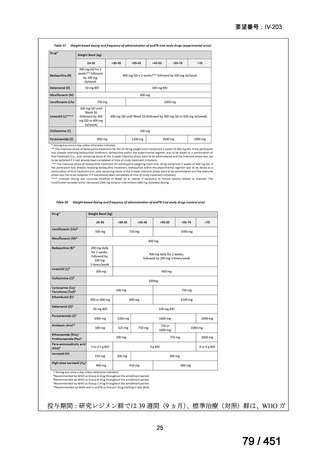
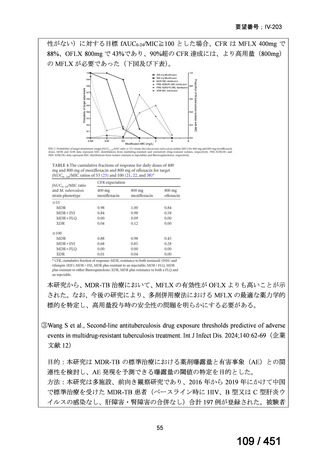
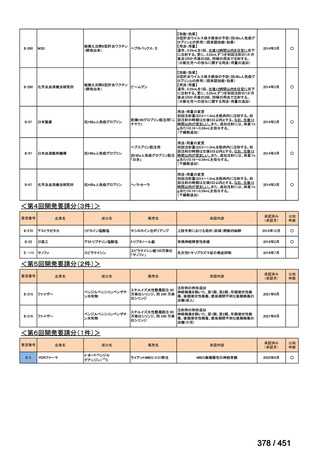
BLMZ レジメンの治療期間の変更
延長
治療期間は通常 9 ヵ月で、臨床反応が遅い場合も、治療期間の延長は推奨されて
いない。
中止
治療への反応の評価には、レジメン開始後 4 ヵ月目の臨床評価と細菌学的反応を
通常利用する。4 ヵ月目までに改善がみられない場合(臨床的に、又は喀痰培養が
134
188 / 451