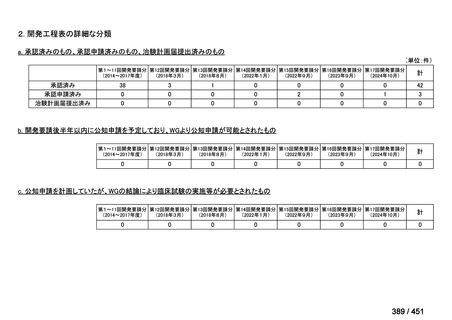
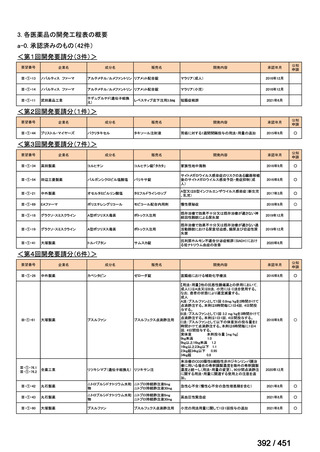
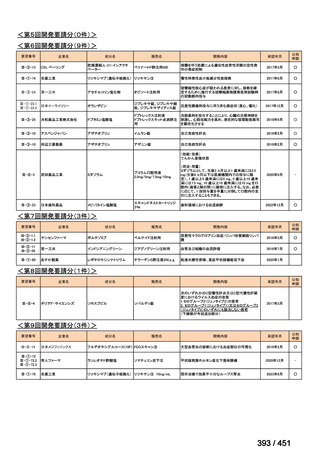
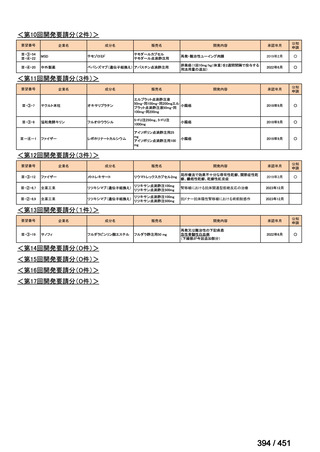
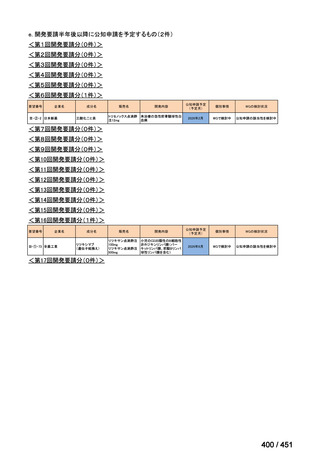
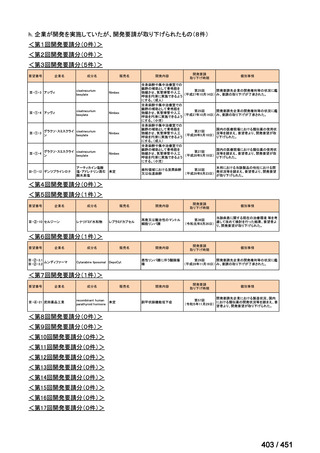
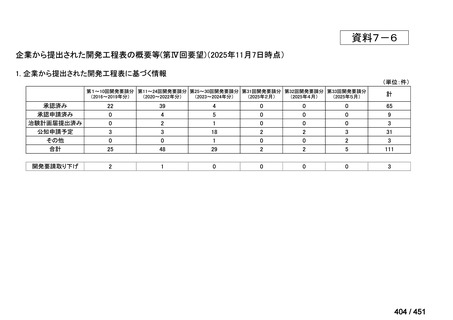
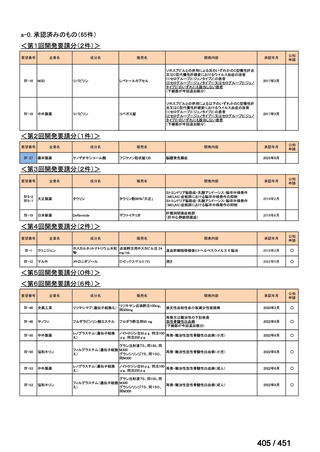
会議資料 (234 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
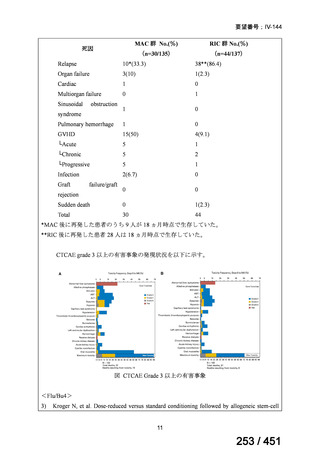
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
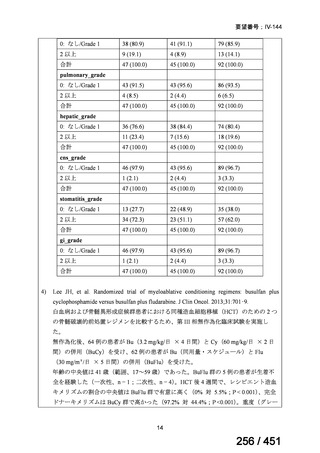
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
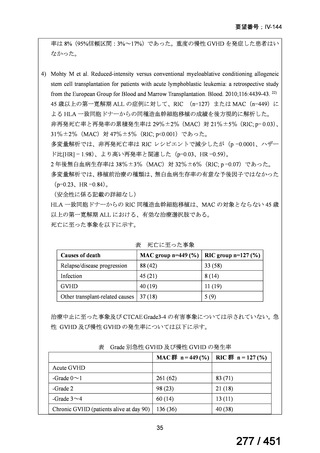
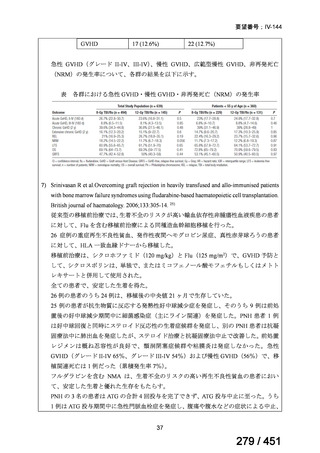
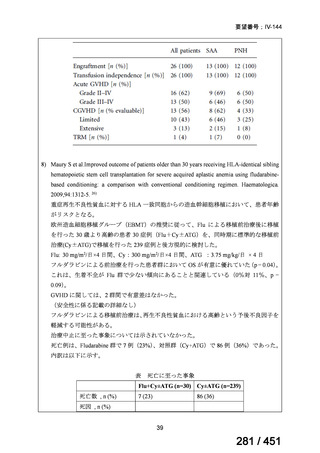
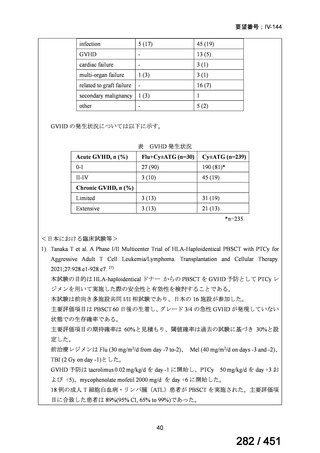
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
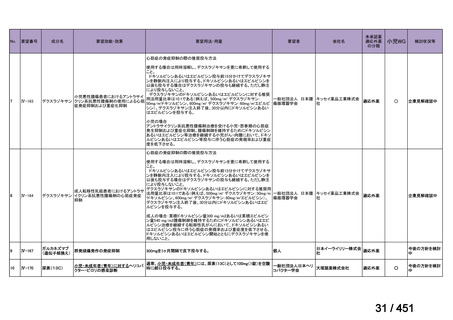
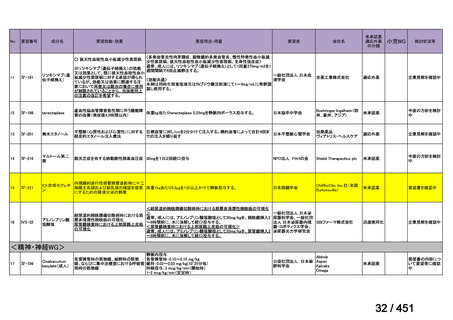
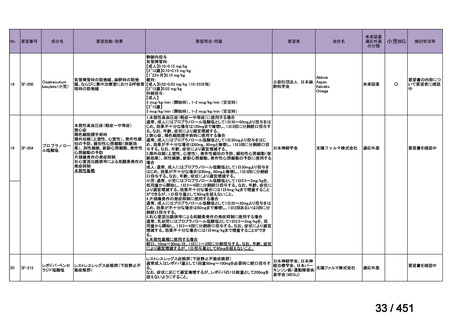
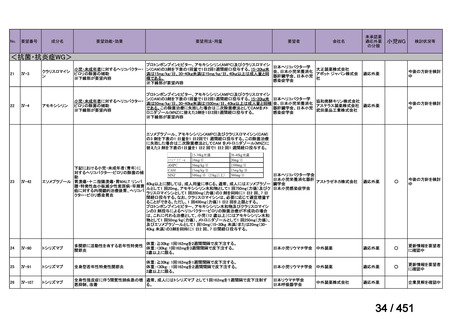
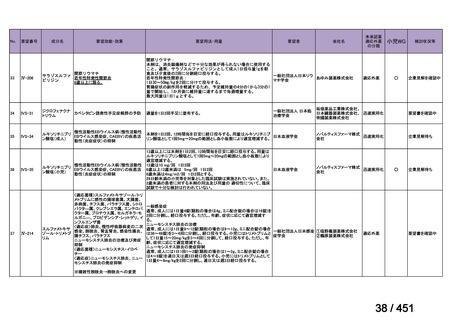
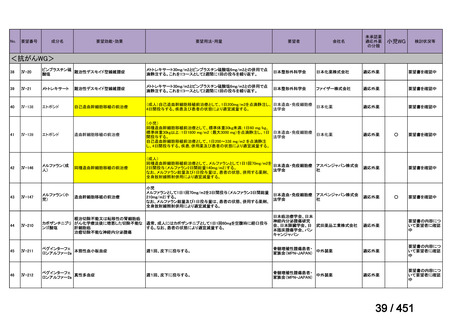
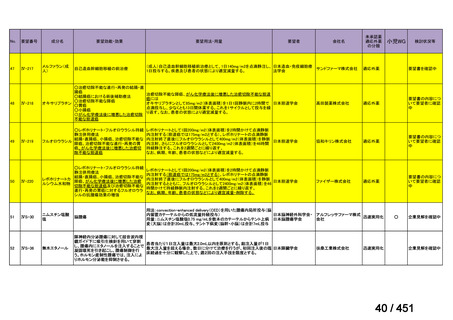
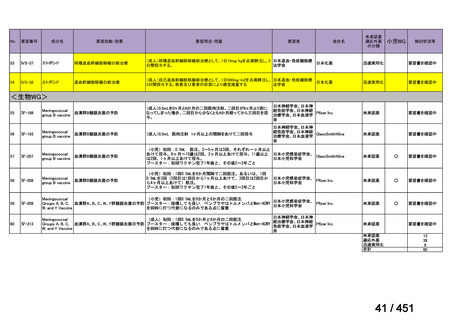
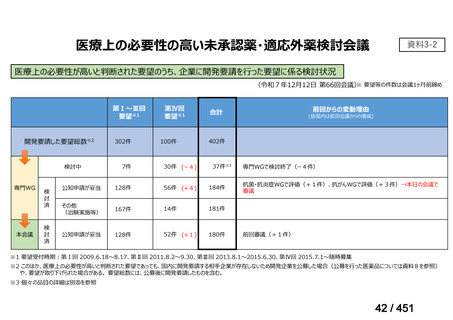
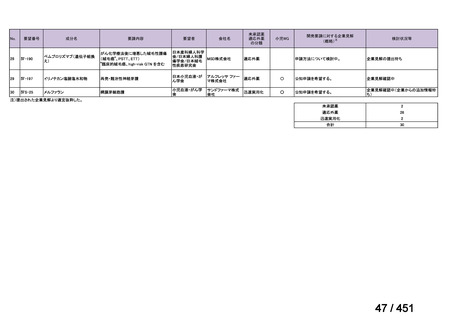
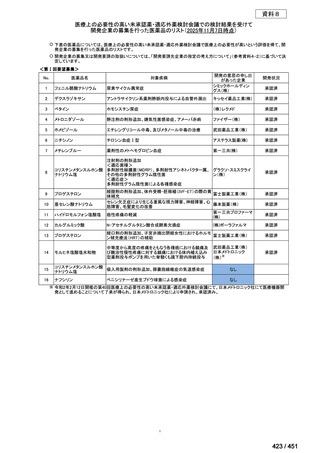
要望番号;IV-122
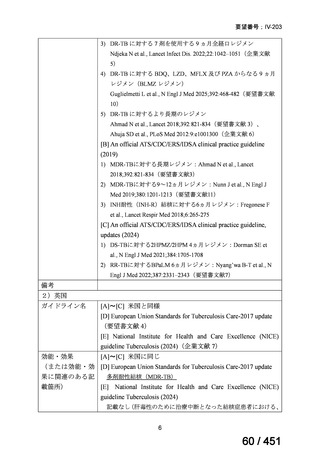
上咽頭癌に対するゲムシタビン(GEM)療法に関する
国内の使用実態調査
2025 年 8 月 7 日 作成
日本頭頸部癌学会より、全国頭頸部がん登録参加施設 230 施設に表題の調査を依頼し、う
ち 78 施設より回答を得た。
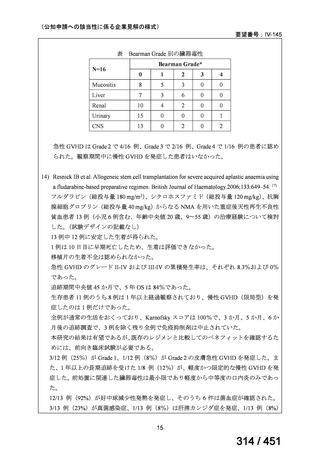
(回答期間:2025 年 6 月 20 日~7 月 31 日。当該施設における過
去のゲムシタビン使用歴について、期間問わずに調査を行った。)
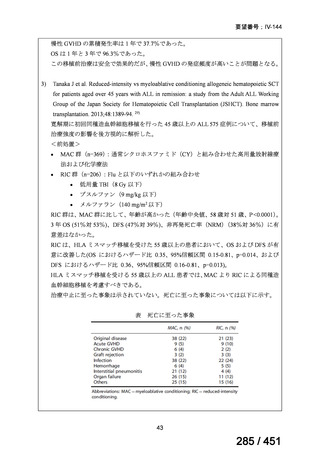
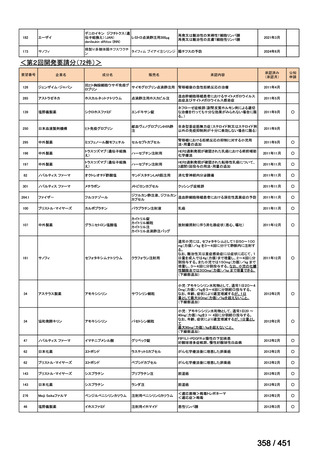
<調査結果 1(全施設)>
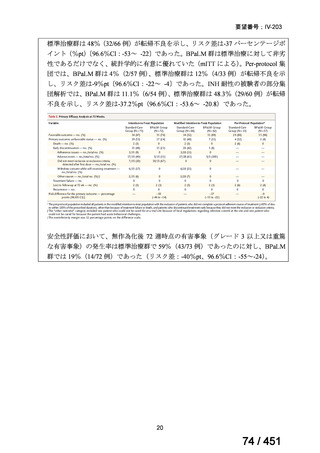
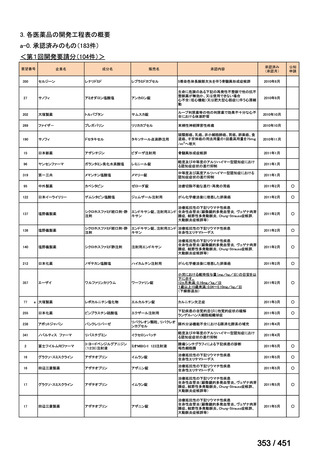
① 上咽頭癌に対する GEM 使用実績の有無
・使用歴あり:10 施設(13%)
・使用歴なし:68 施設(87%)
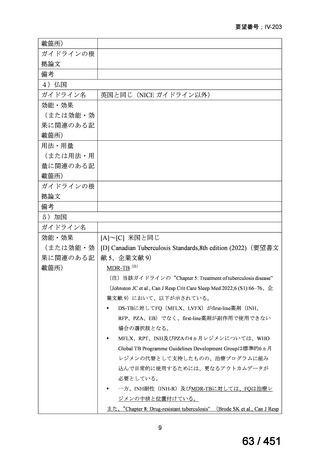
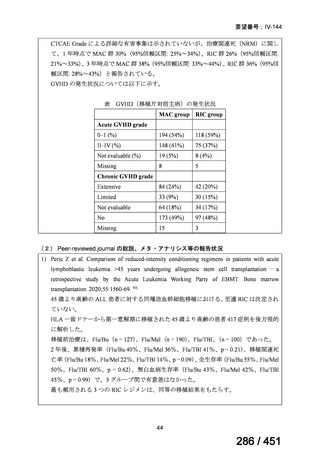
<調査結果 2(ゲムシタビン使用歴あり
計 10 施設)>
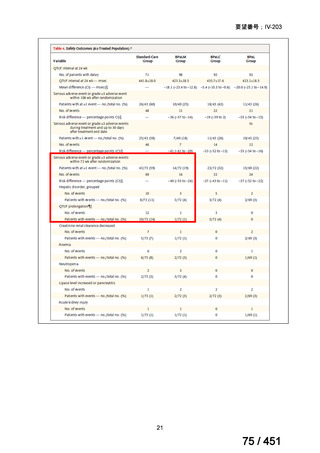
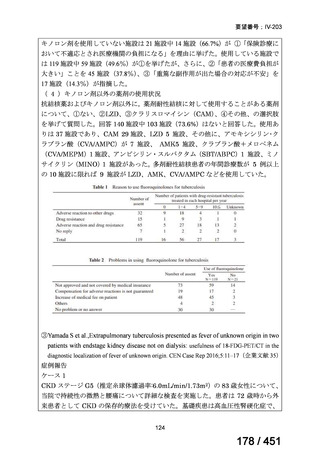
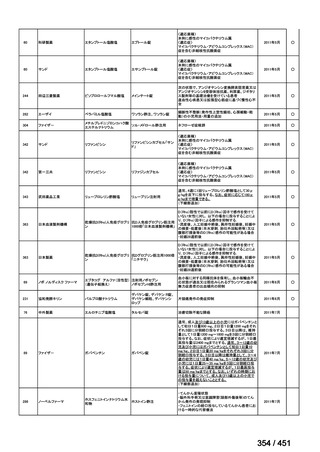
② GEM 療法の投与目的およびレジメン
・導入化学療法としての GEM+CDDP :4 施設、計 19 例(うち自費診療 2 例)
・再発転移例に対する GEM+CDDP
:4 施設、計 22 例(うち自費診療 1 例)
・再発転移例に対する GEM 単剤
:9 施設、計 58 例(うち自費診療 9 例)
・再発転移例に対する GEM+CBDCA :1 施設、計 2 例 (うち自費診療 0 例)
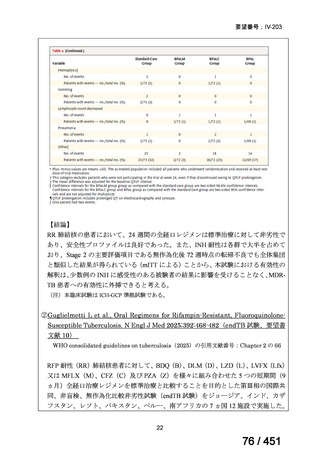
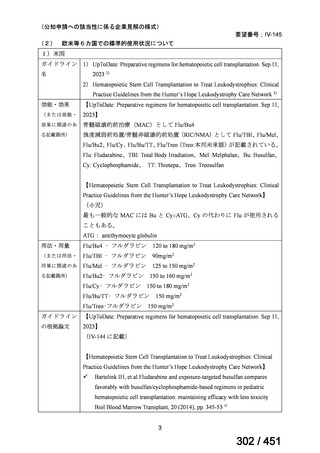
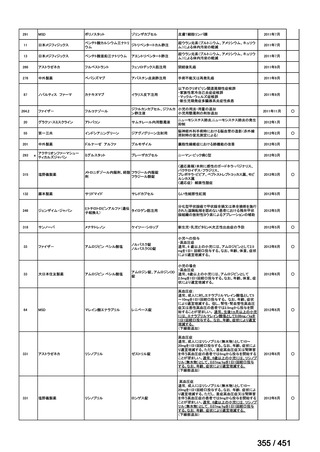
③ GEM 療法の用法用量
・導入化学療法、または、再発転移例に対する投与のいずれかの使用歴のある全施設におい
て、「GEM (1000mg/m2, day1 and 8)+CDDP (80mg/m2, day1)、3 週ごと」
・再発転移例に対する GEM 単剤:
使用歴のある全 9 施設中、
「GEM 1000 ㎎/m2、3 週投与 1 週休薬」 :7 施設
「GEM 800 ㎎/m2、3 週投与 1 週休薬」
:1 施設
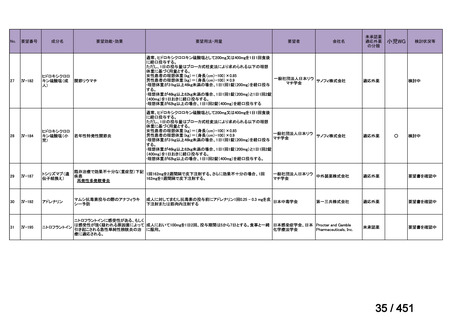
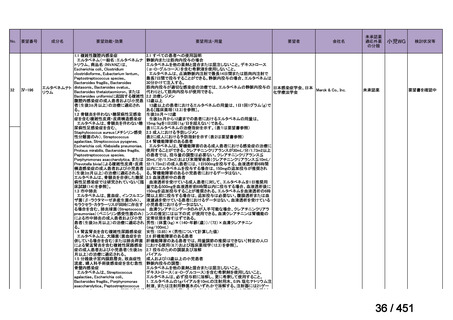
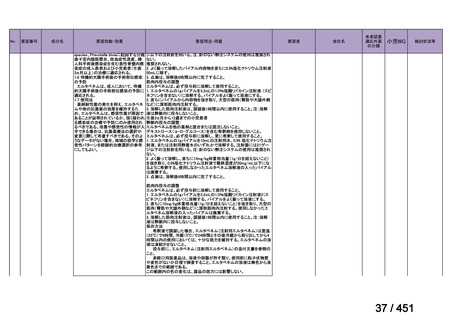
「上記の両者を使用」
:1 施設
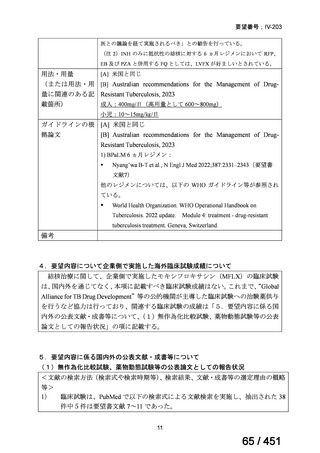
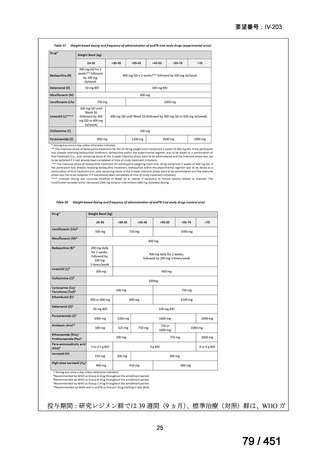
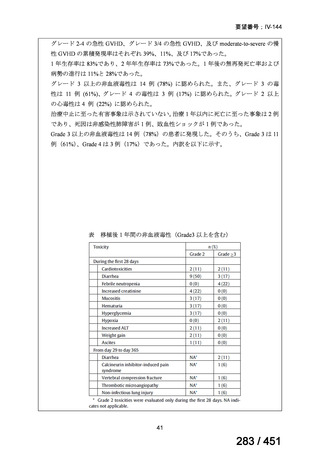
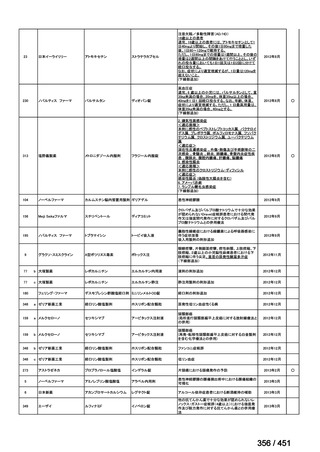
④ GEM 療法投与時の有害事象
使用歴のある 10 施設すべてから、
「予期せぬ有害事象なし」との報告を得た。
導入化学療法としての GEM+CDDP 使用歴のある 1 施設から、
「従来の導入化学療法であ
る TPF 療法(ドセタキセル+シスプラチン+5FU 療法、血球減少や消化管毒性などが強い)
に比してより総じて有害事象が軽度でコントロールしやすい印象あり」との回答を得た。
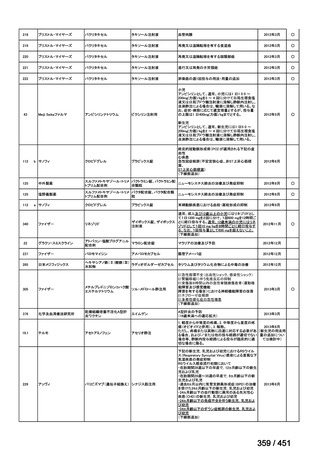
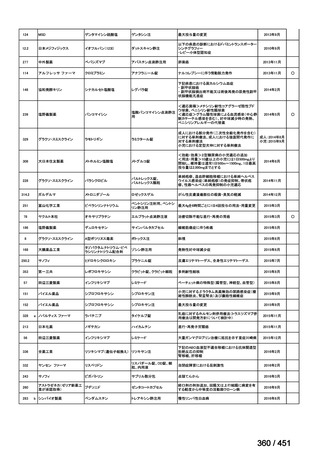
<調査結果 3(導入化学療法としての GEM+CDDP 施行歴あり
計 4 施設)>
1
234 / 451