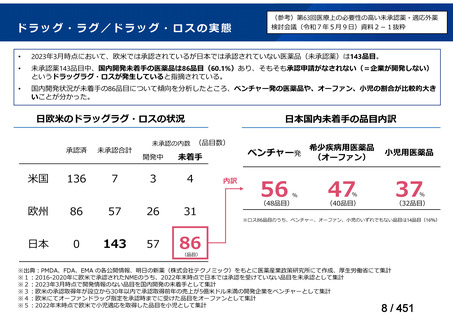
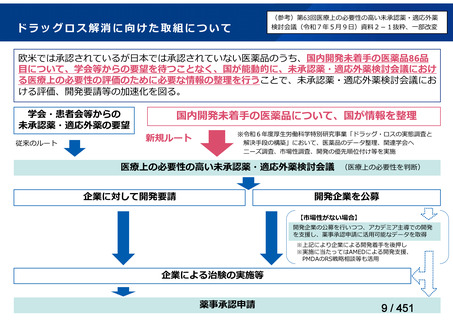
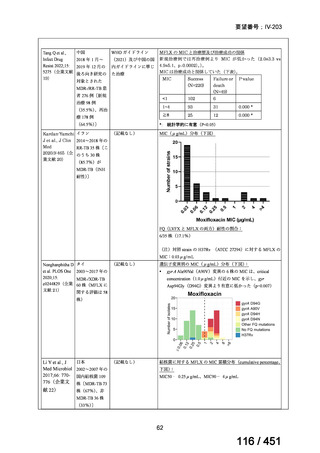
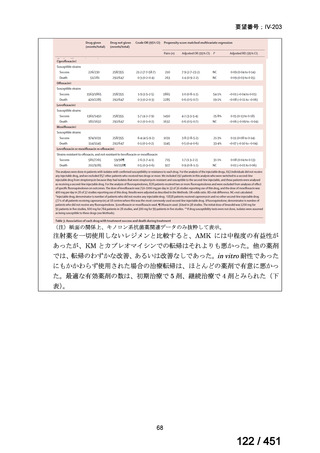
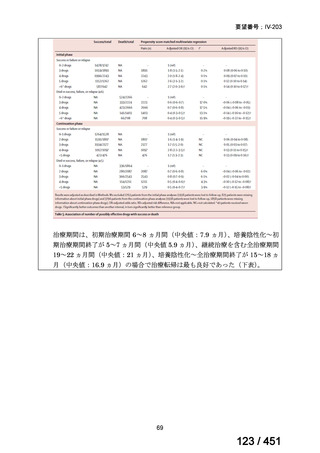
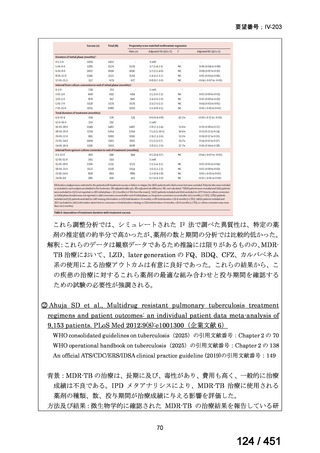
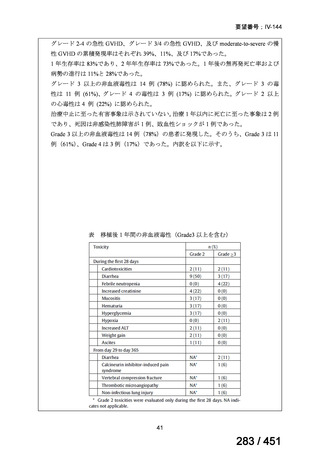
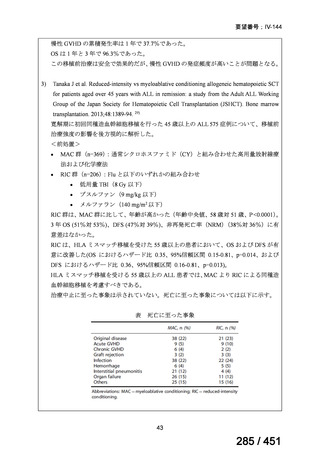
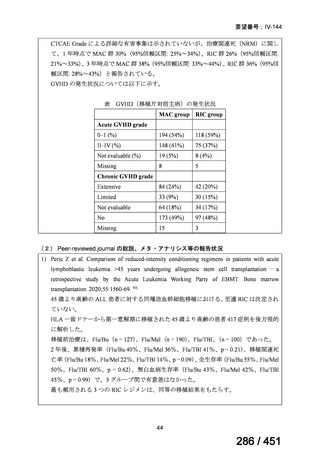
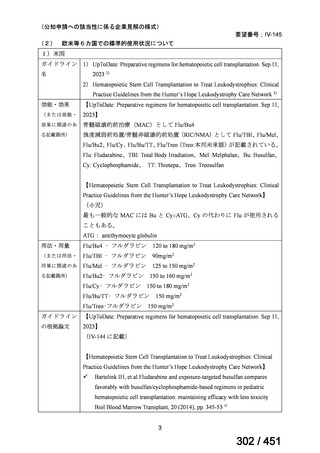
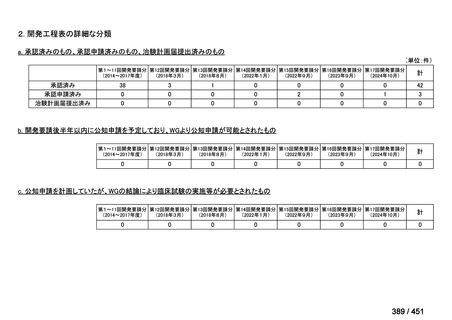
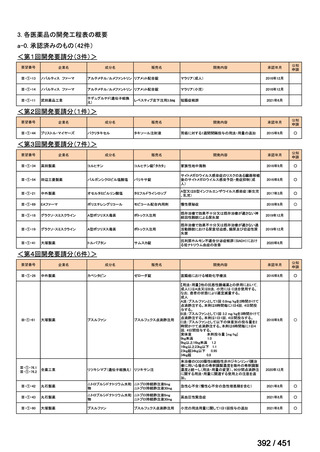
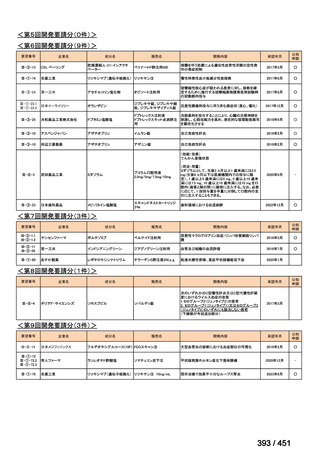
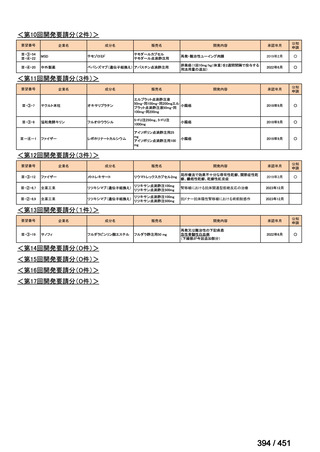
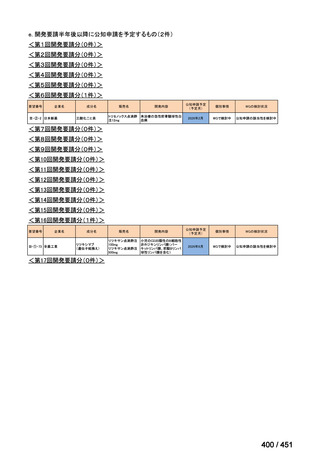
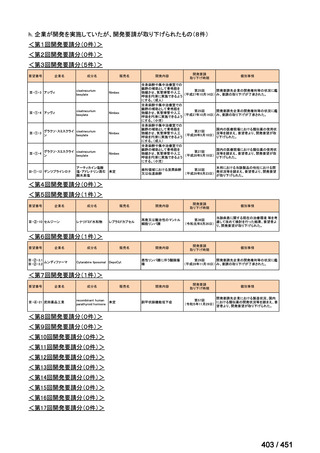
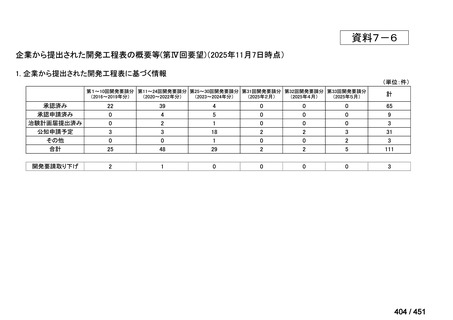
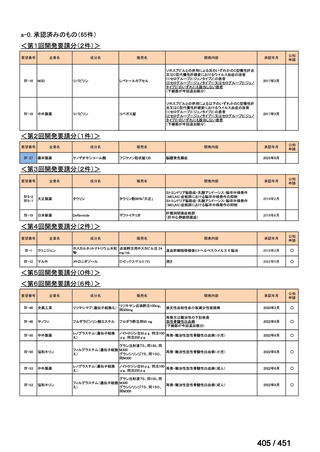
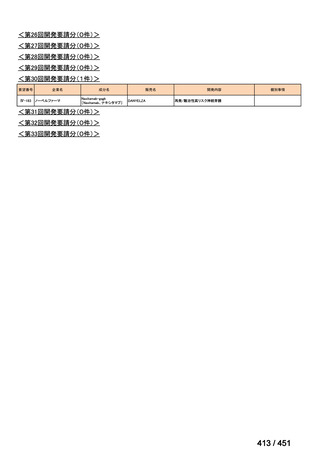
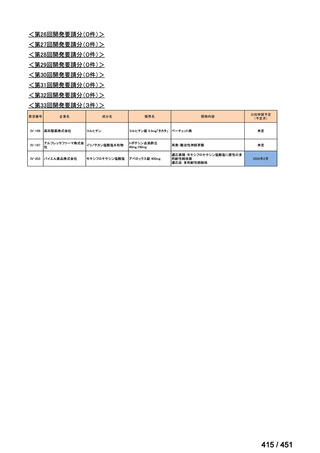
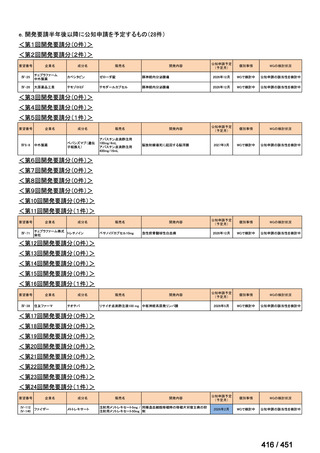
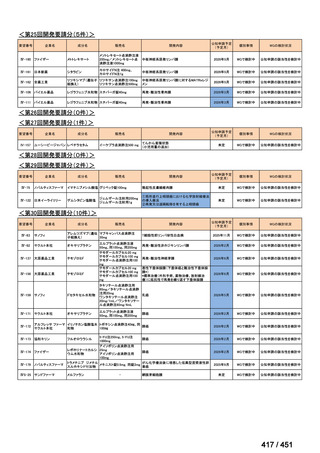
会議資料 (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
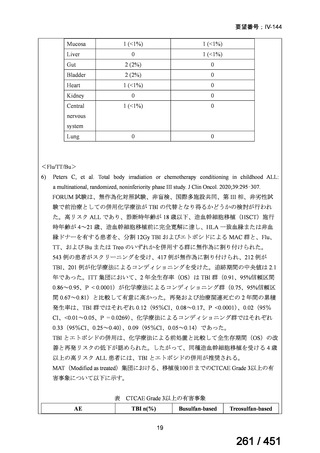
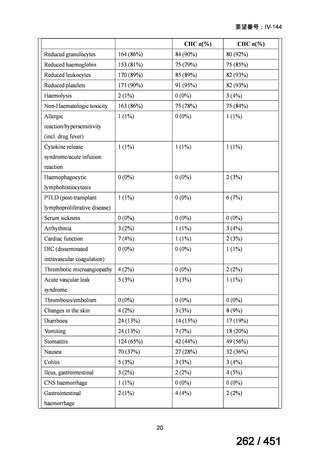
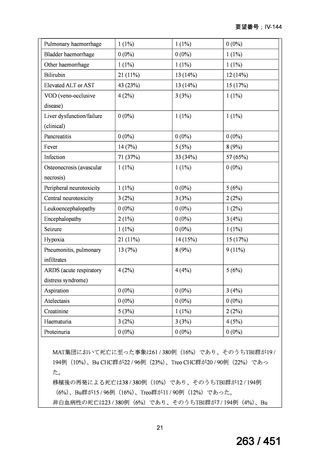
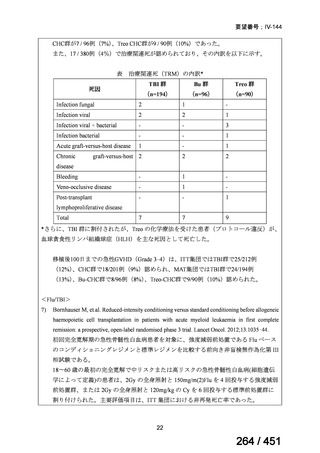
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
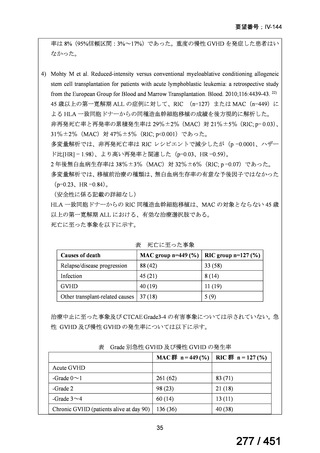
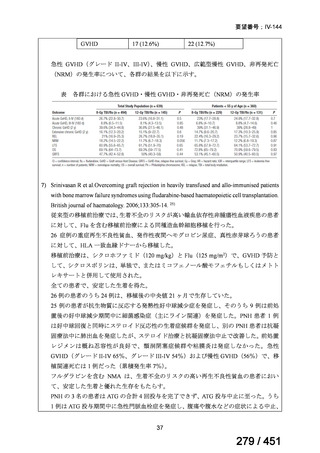
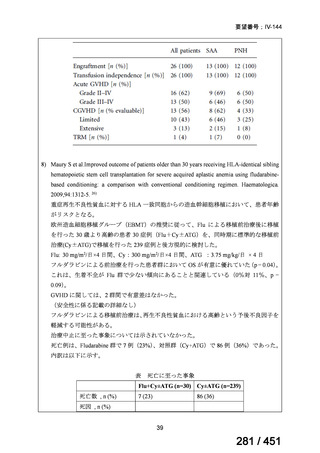
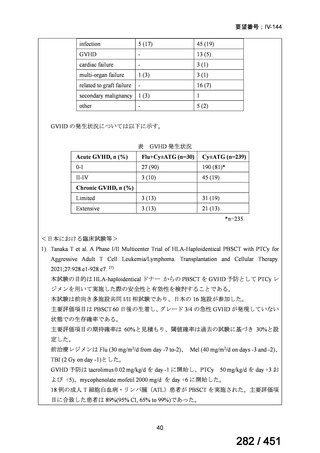
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
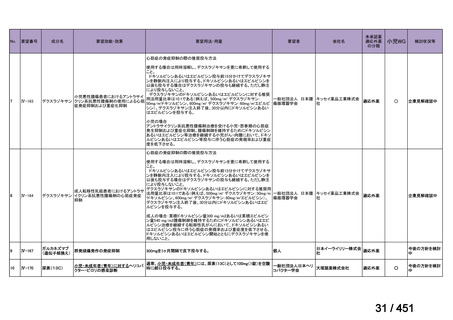
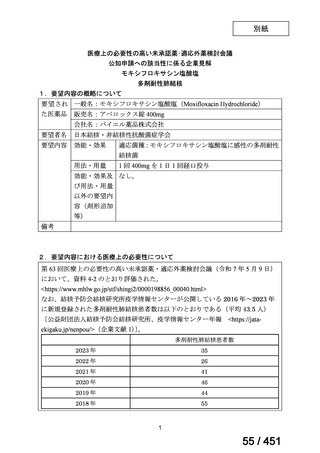
要望番号;IV-203
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
モキシフロキサシン塩酸塩
多剤耐性肺結核
1.要望内容の概略について
要 望 さ れ 一般名:モキシフロキサシン塩酸塩
た医薬品
販売名:アベロックス錠 400mg
会社名:バイエル薬品株式会社
要望者名
日本結核・非結核性抗酸菌症学会
要望内容
効能・効果
適応菌種:モキシフロキサシン塩酸塩に感性の多剤耐性結核
菌(MDR-TB)
適応症:多剤耐性肺結核[イソニコチン酸ヒドラジドとリフ
ァンピシンに耐性の結核菌を本剤の適応症とする]
用法・用量
1 回 400mg を 1 日 1 回経口投与
効能・効果及び なし。
用法・用量以外
の要望内容(剤
形追加等)
備考
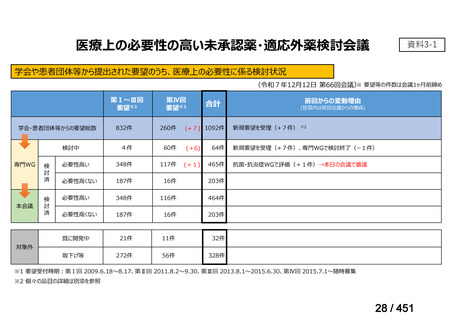
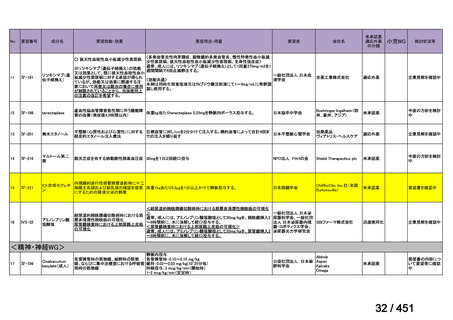
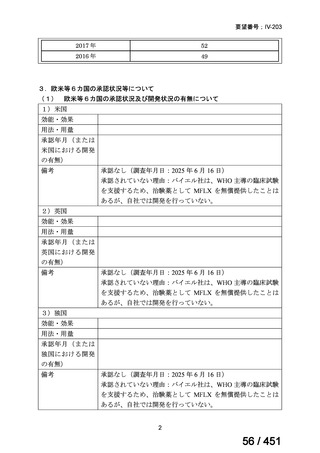
2.要望内容における医療上の必要性について
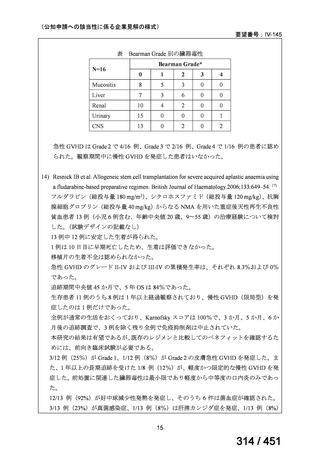
第 63 回医療上の必要性の高い未承認薬・適応外薬検討会議(令和 7 年 5 月 9 日)にお
いて、別添のとおり医療上の必要性の基準に該当すると判断した。
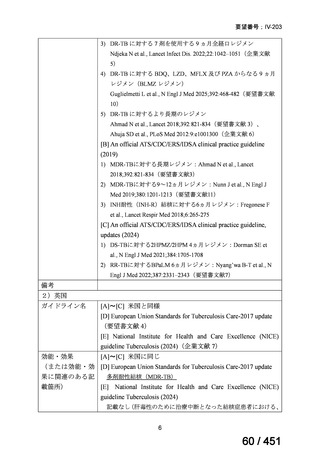
3.公知申請の妥当性について
企業見解を提出した企業は、公知申請の妥当性について以下のとおり説明している。
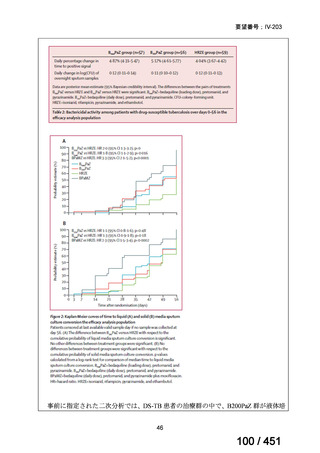
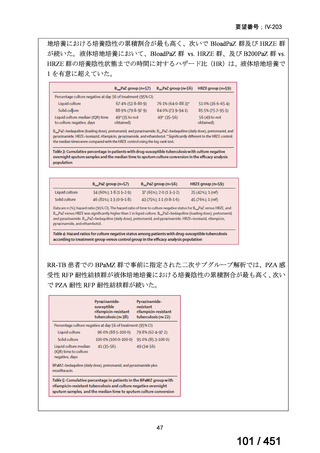
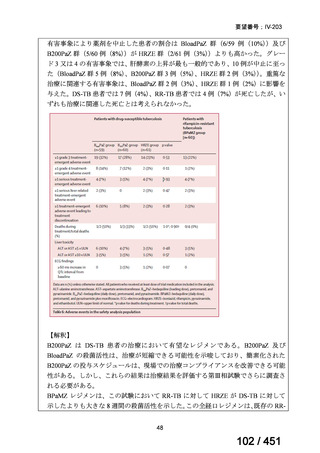
モキシフロキサシン塩酸塩(以下、
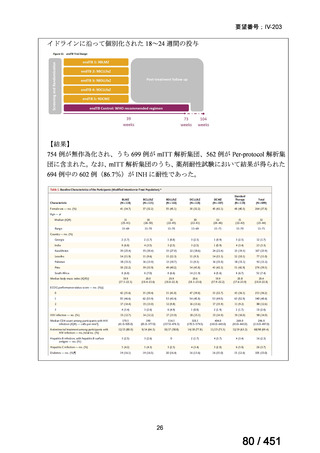
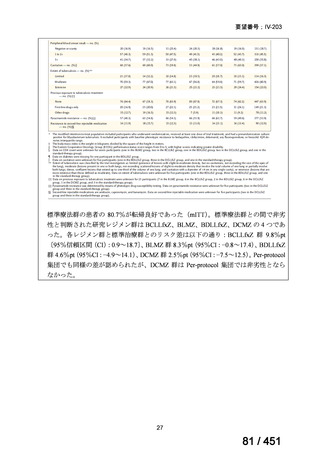
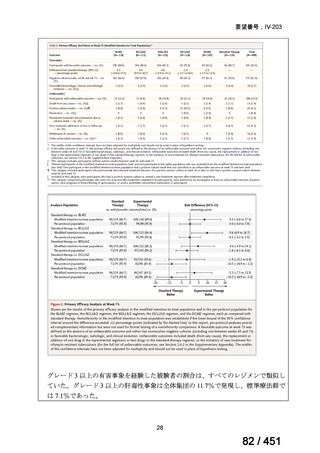
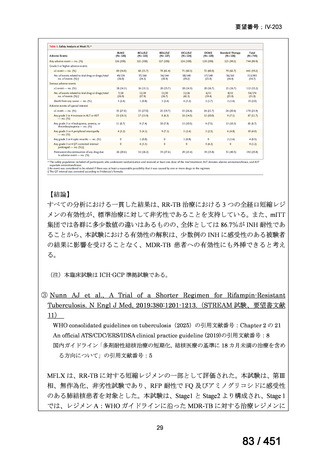
「本薬」)は、WHO ガイドラインにおける多剤耐性
肺結核に対する治療レジメン(6 カ月 BPaLM1)レジメン、9 カ月 BLMZ2)レジメン、9 カ
月 7 剤併用レジメン及び 18~20 カ月長期レジメン)の構成要素とされており、多剤耐
性肺結核に対する治療の中心となる薬剤であると考えている(別紙の企業見解 p.140)
。
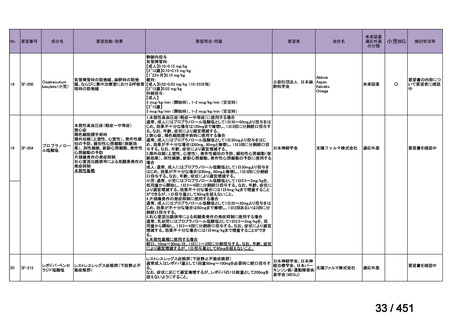
1)
ベダキリン、Pretomanid、リネゾリド及びモキシフロキサシン塩酸塩。なお、Pretomanid は令和 7 年 12 月現在、
本邦では未承認である。
2) ベダキリン、リネゾリド、モキシフロキサシン塩酸塩及びピラジナミド
1
51 / 451