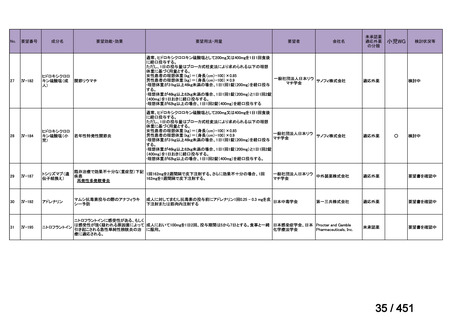
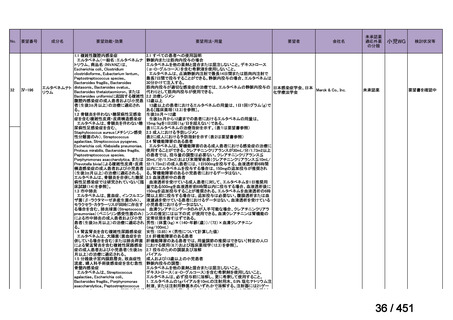
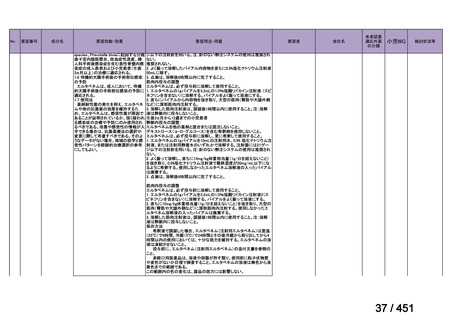
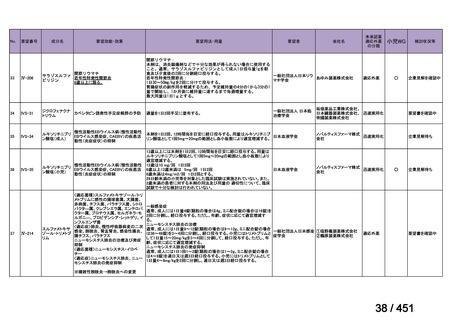
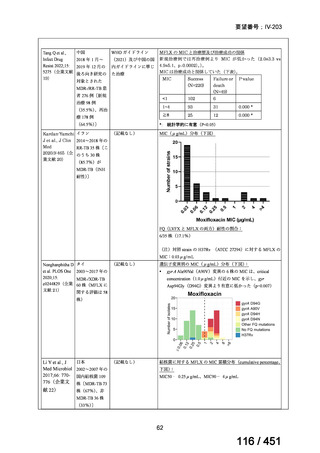
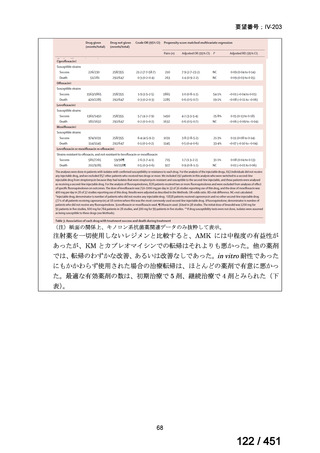
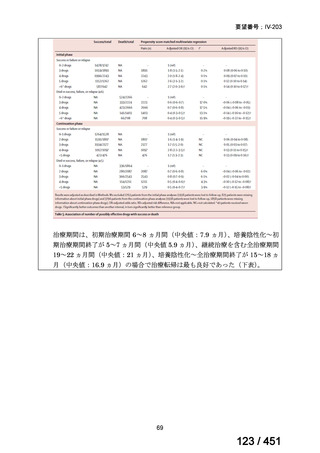
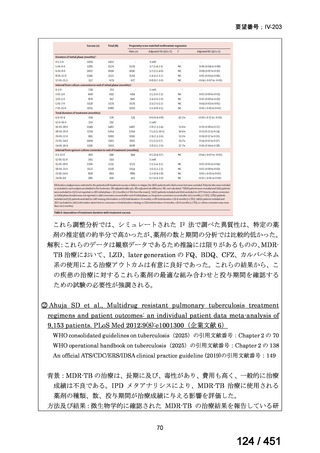
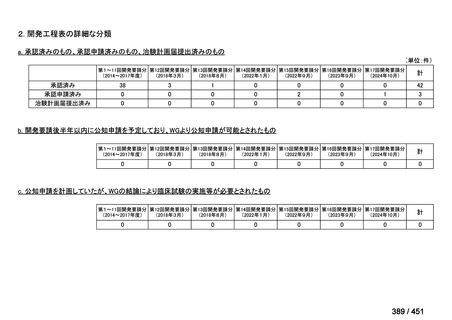
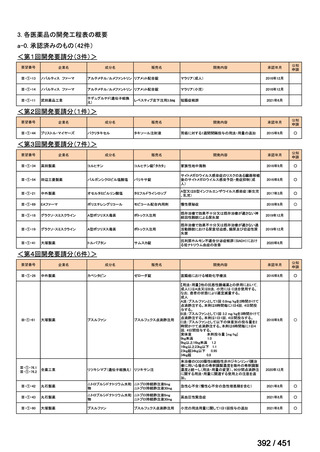
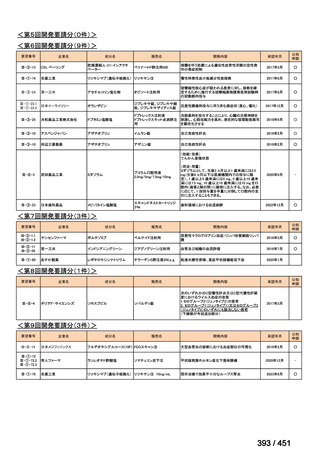
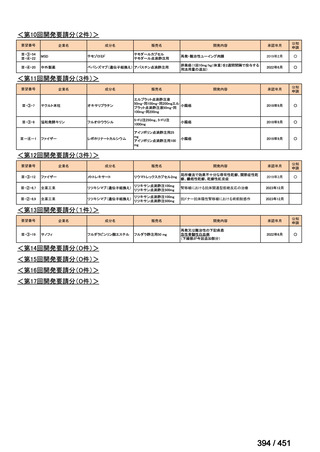
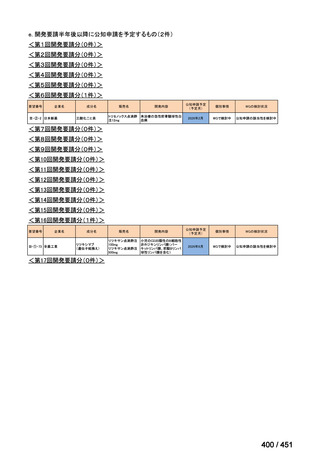
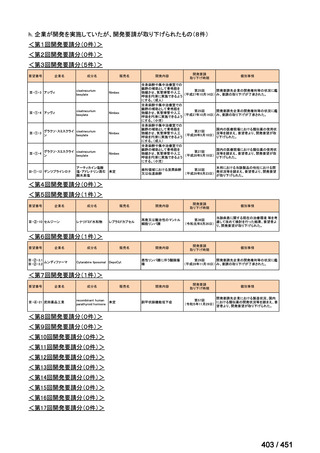
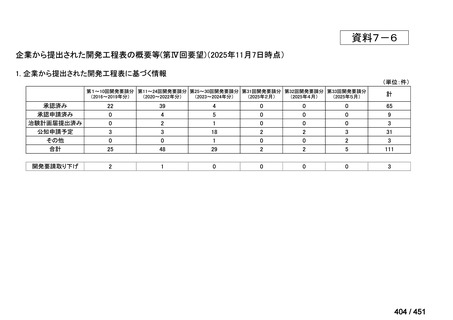
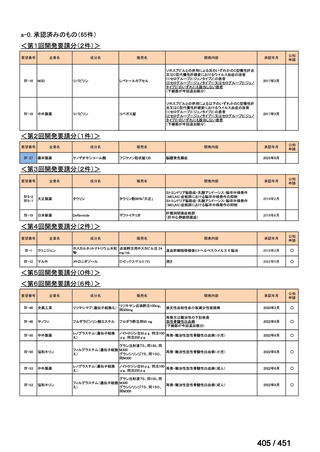
会議資料 (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
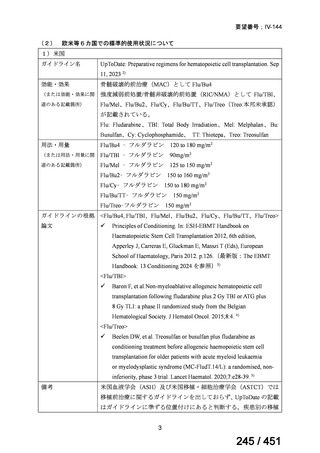
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
検索式:("clinical study" OR "clinical trial") AND ("drug-resistant" OR "rifampicin-resistant" OR
"rifampin-resistant" OR "isoniazid-resistant" OR "multidrug-resistant" OR "multi-drug
resistant" OR "extensively multidrug resistant" OR "extensively multi-drug resistant") AND
("tuberculosis" AND "moxifloxacin")
検索実施日:2025 年 4 月 22 日
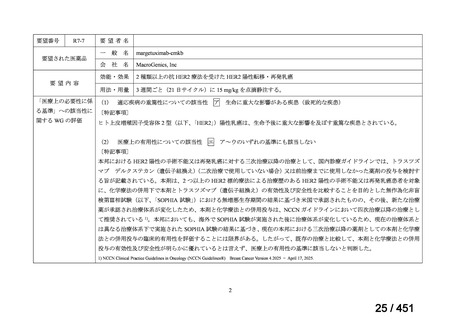
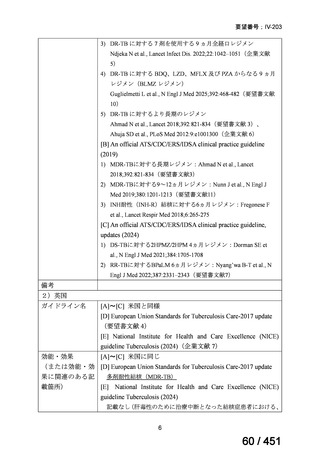
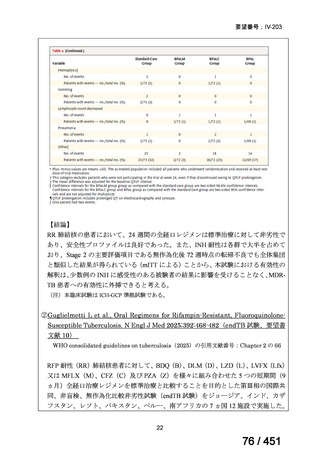
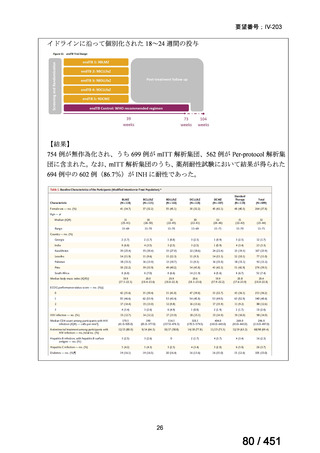
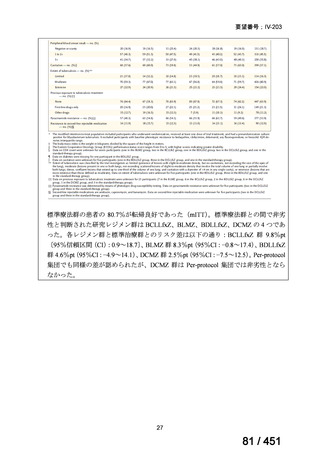
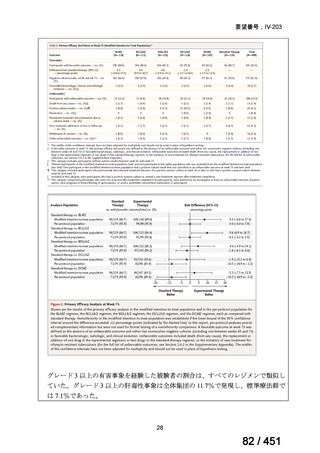
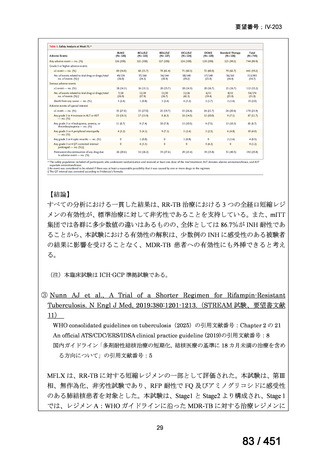
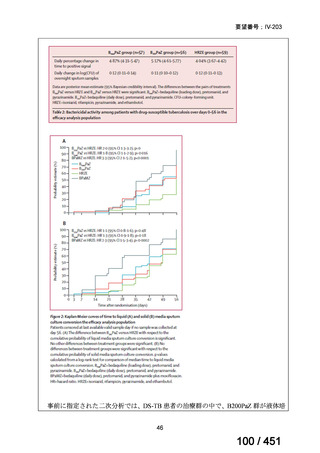
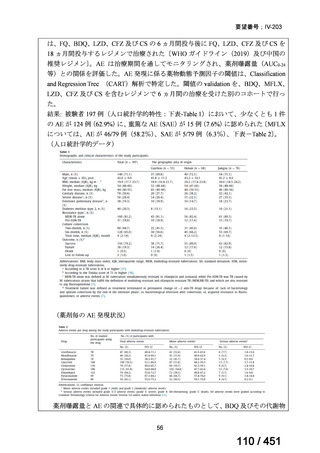
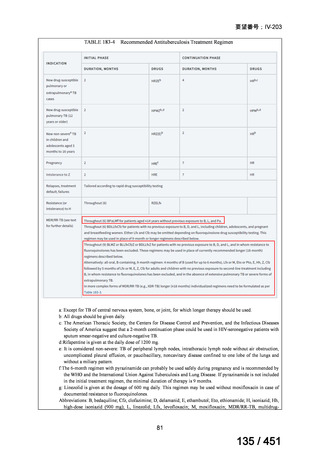
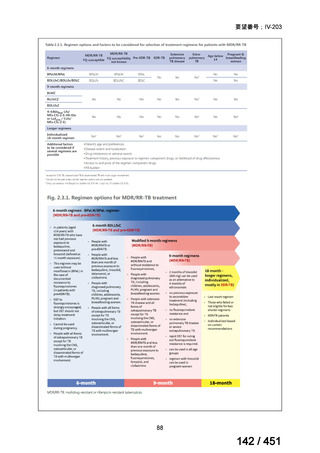
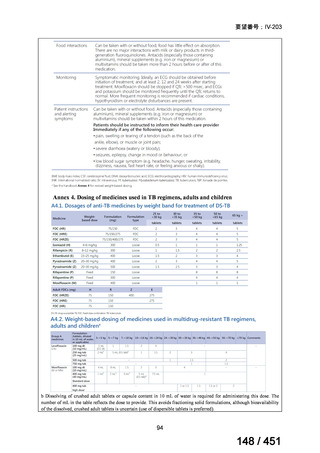
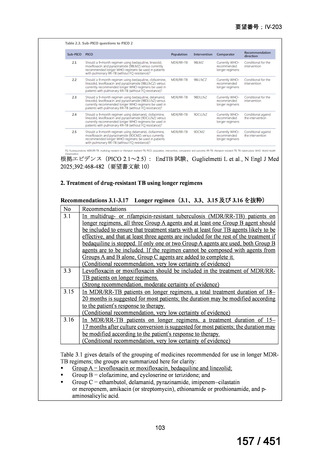
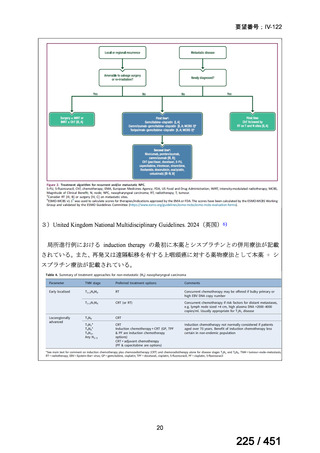
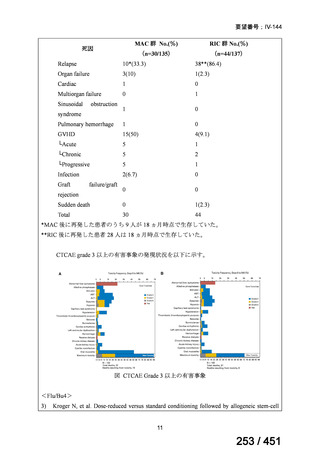
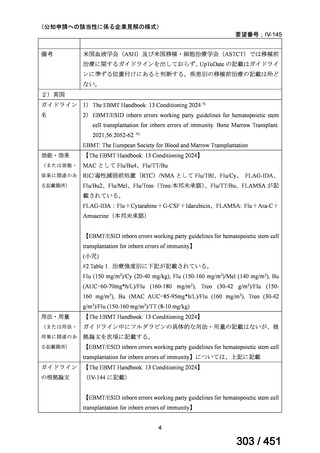
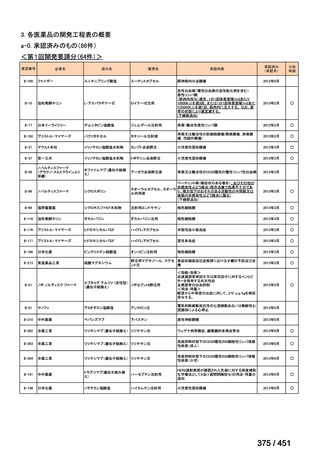
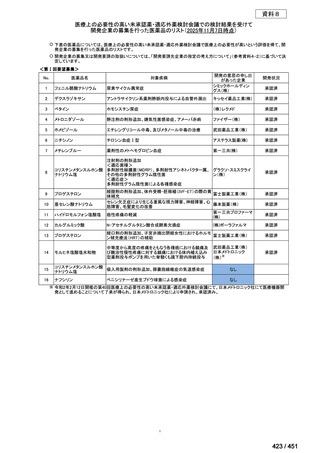
WHO ガイドライン(2025)が推奨する多剤耐性結核(MDR-TB)の治療レジメ
ンのうち、モキシフロキサシン(MFLX)を使用するレジメンは、以下の 4 つ
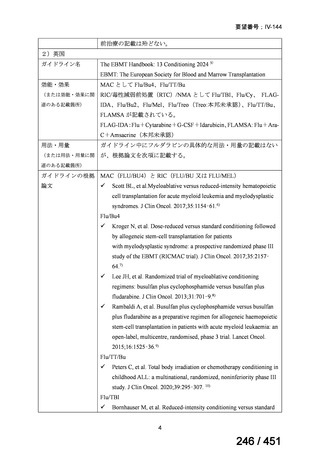
である。
6ヵ月BPaLMレジメン〔根拠エビデンス:TB-PRACTECAL試験(要望
書文献7、本企業見解16~22頁)〕
9ヵ月BLMZレジメン〔根拠エビデンス:endTB試験(要望書文献10、
同22~29頁)〕
9ヵ月短縮レジメン〔7剤併用、根拠エビデンス:STREAM試験(要望
書文献11、同29~35頁)〕
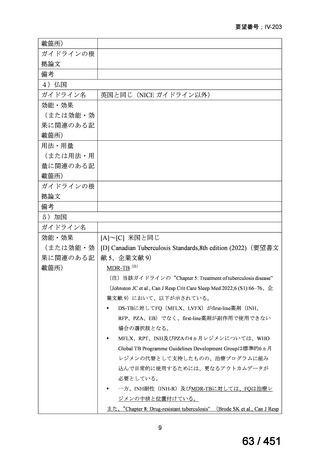
18~20ヵ月長期レジメン
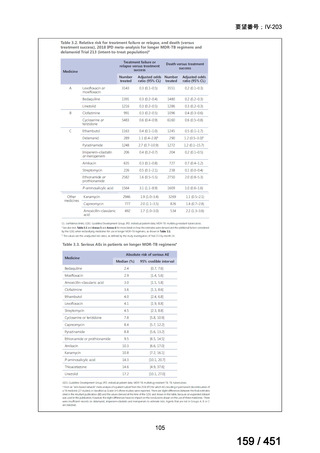
このうち、WHO ガイドラインにおける 18~20 ヵ月長期レジメンの推奨根拠
は、Individual patient data(IPD)に対するメタアナリシス(要望書文献 3 等)
であるため、それらについては「5.
(2) Peer-reviewed journal の総説、メタ・
アナリシス等の報告状況」の項で詳述する。
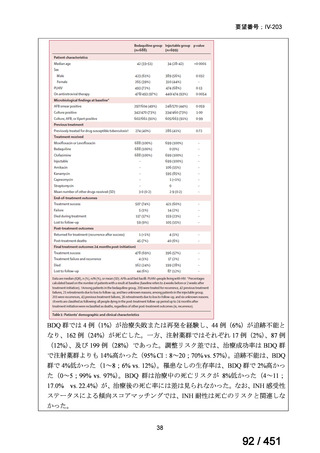
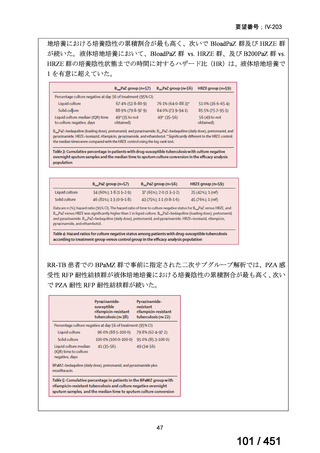
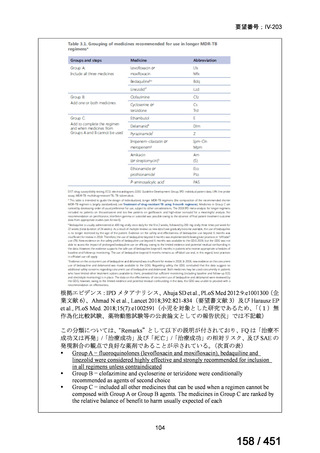
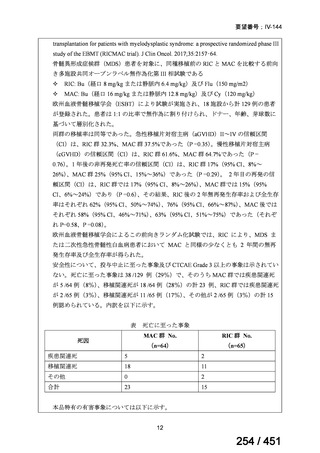
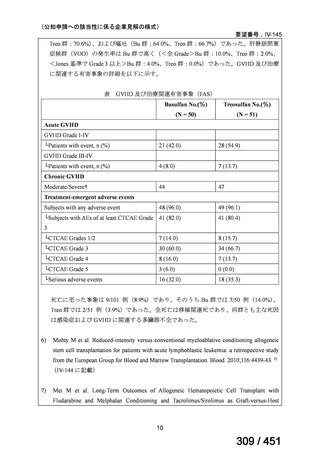
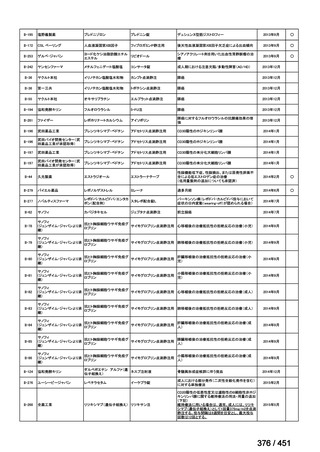
WHO ガイドライン(2025)では、9 ヵ月短縮レジメン(BDQ 6 ヵ月投与含む)
の説明において 1 件の後ろ向き観察研究(企業文献 5)も引用されている。FQ
耐性を否定できる MDR/RR-TB 患者に対して 9 ヵ月全経口レジメンの使用をよ
り長期の 18 ヵ月レジメンよりも優先する提言の根拠とされた研究の報告であ
ることに加え、STREAM 試験での 9~11 ヵ月短縮レジメンにおいては、高用量
の MFLX(体重 33kg 未満は 400mg/日、33~50kg で 600mg/日、50kg 超で 800mg/
日)が使用されている一方で、当該観察研究では MFLX 10~15mg/kg/日(最大
1 日用量 400mg)が使用されており、用法・用量の考察において重要な情報と
考えられたので、追記した(本企業見解 35~39 頁)。
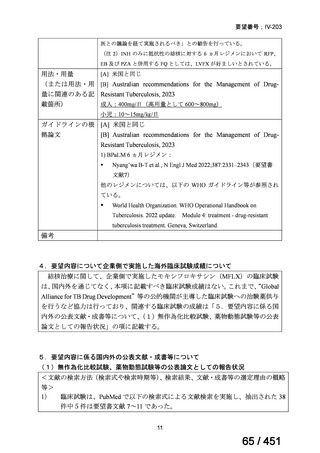
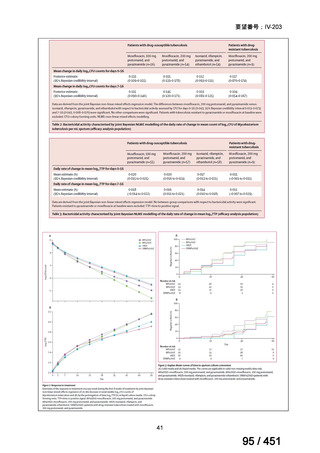
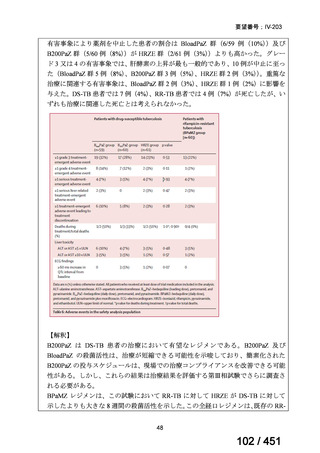
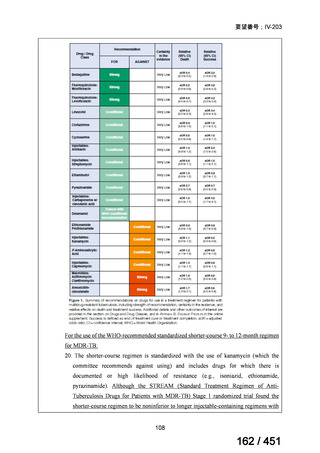
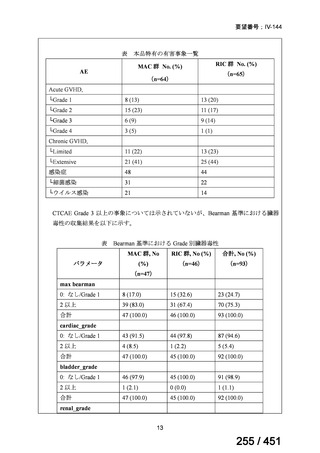
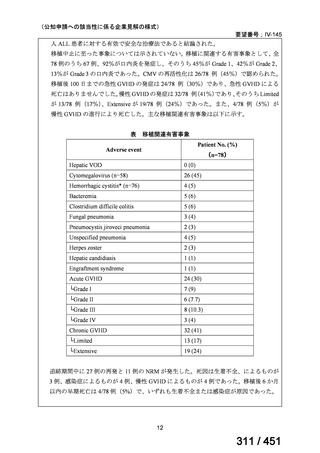
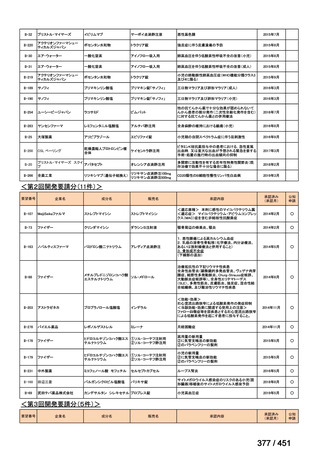
なお、要望書文献 8 は、 BDQ を含まない 3 剤(MFLX、プレトマニド、PZA)
を MDR-TB も含めて検討した試験、要望書文献 9 は BDQ を含む BPaMZ レジ
メンを RR-TB に対して検討した試験であり、上記の 4 レジメンの推奨根拠に
直接関連しないが、MFLX をプレトマニド及び PZA や、BDQ と併用した際の
殺菌活性を示す情報として、記載した(同 39~49 頁)。
なお、薬剤感受性結核(DS-TB)患者を対象として MFLX を含むレジメンを検
討した臨床試験の文献は、WHO ガイドライン等で引用されているものの、今
回の要望対象ではないため、不記載とした。
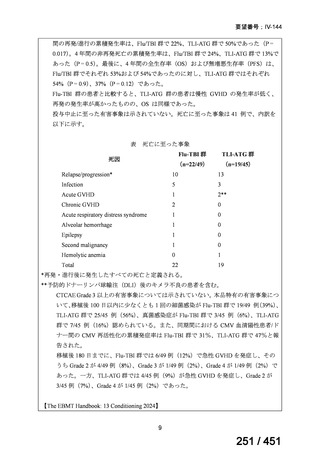
こ れ ら の 臨 床 論 文 の 検 索 作 業 で は 、 ClinicalTrial.gov で “ Condition/disease:
12
66 / 451