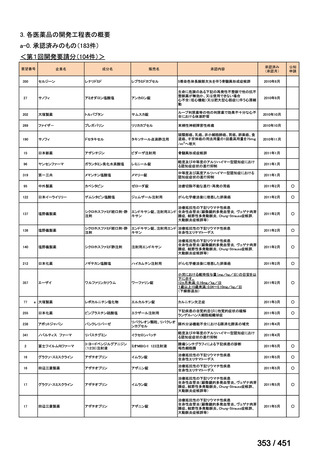
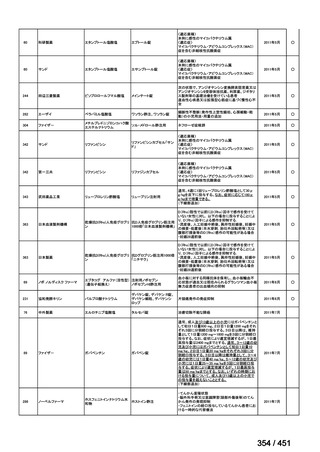
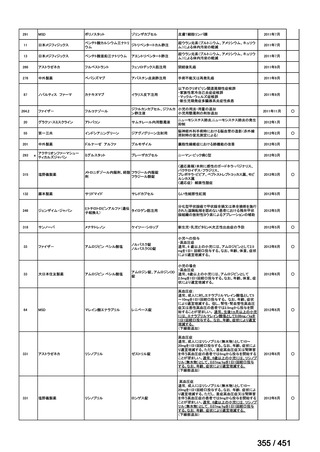
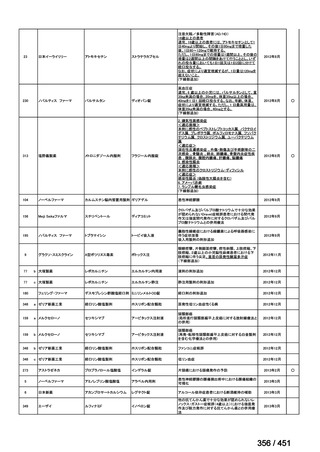
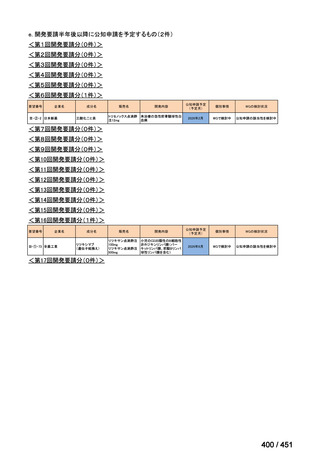
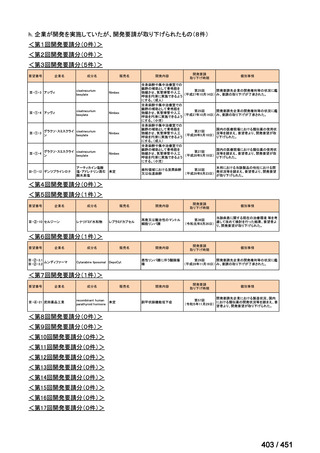
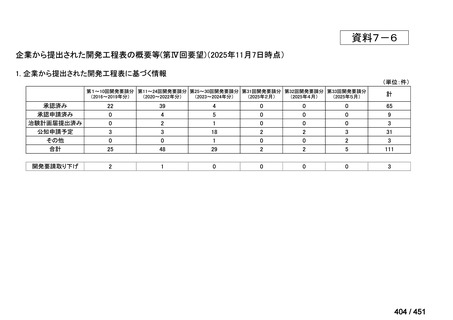
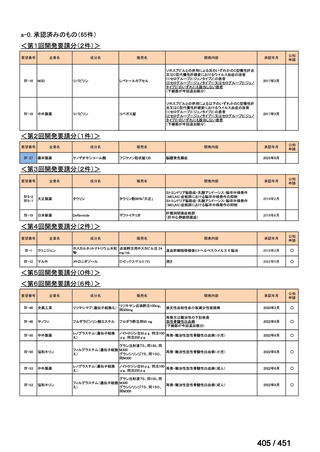
会議資料 (427 ページ)
出典
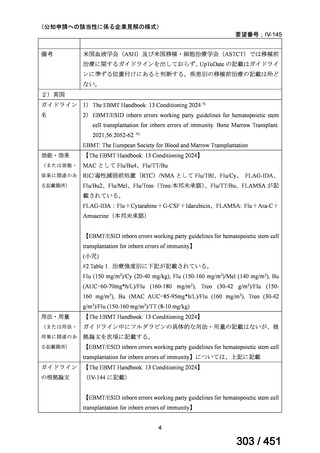
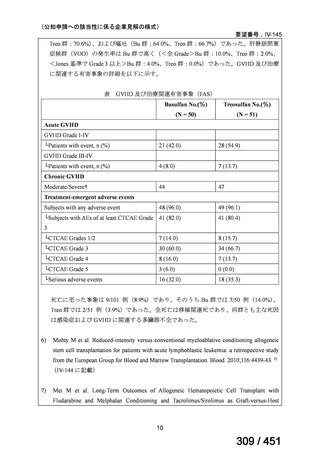
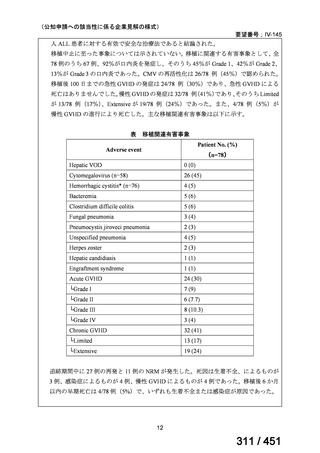
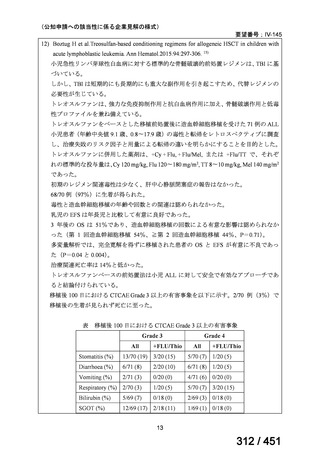
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
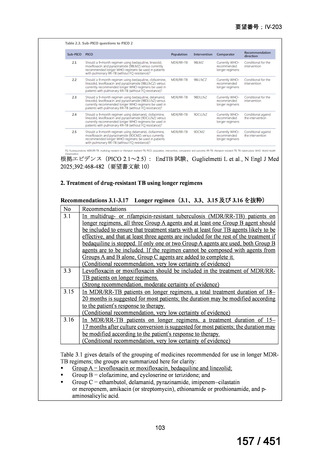
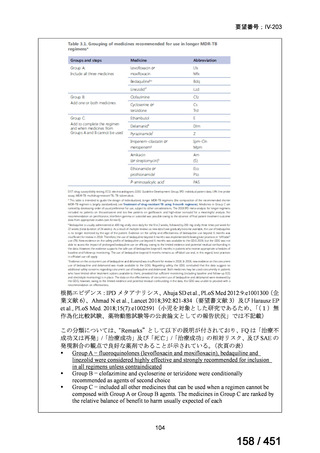
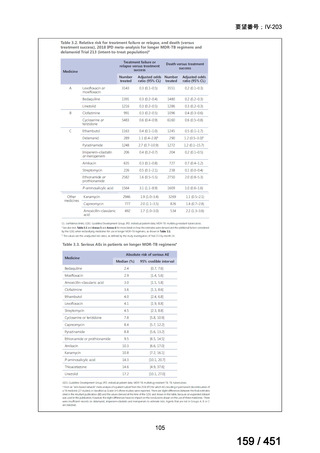
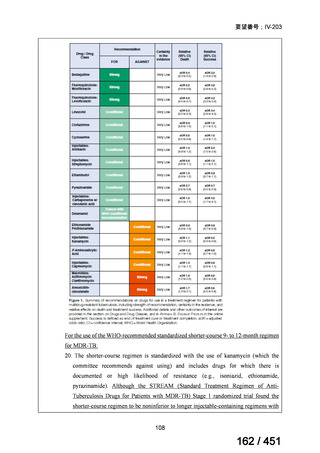
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
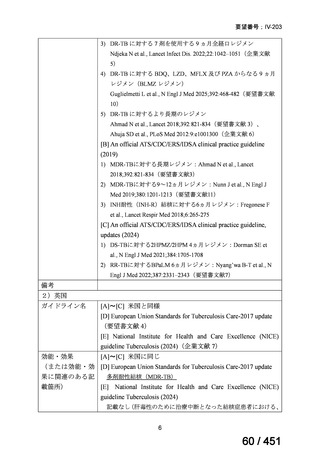
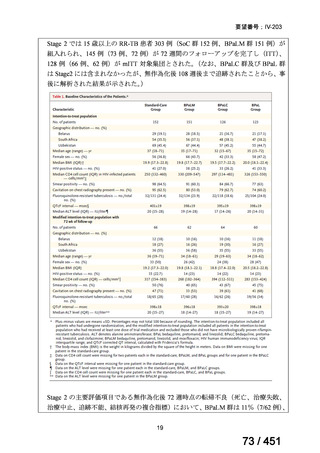
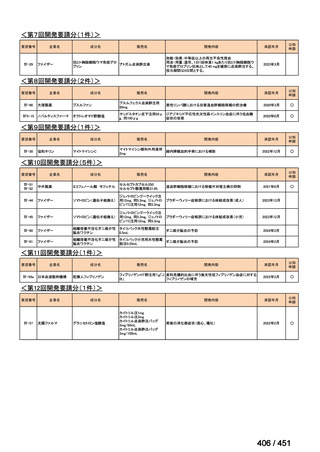
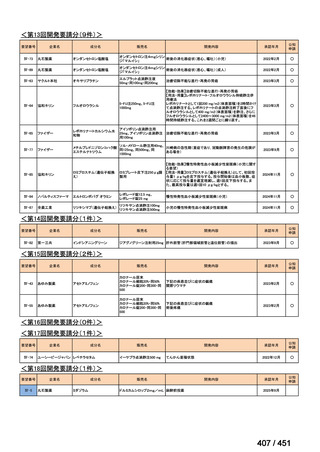
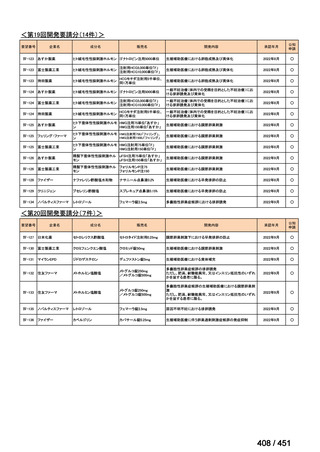
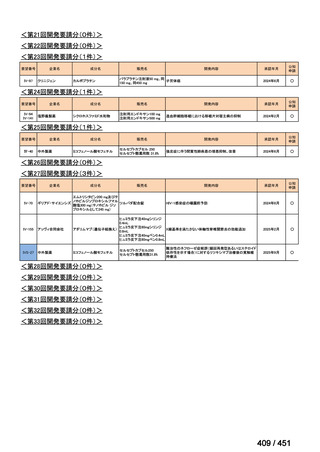
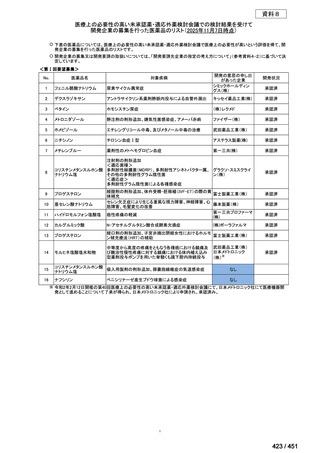
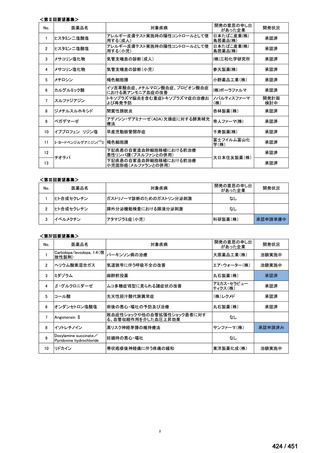
法律等の一部を改正する法律(令和元年法律第63号)
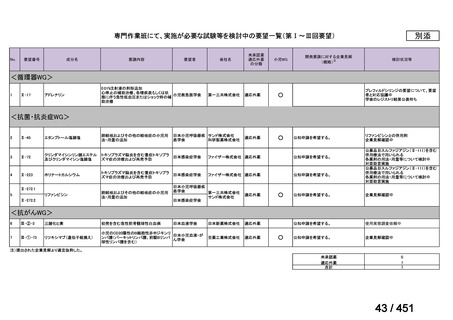
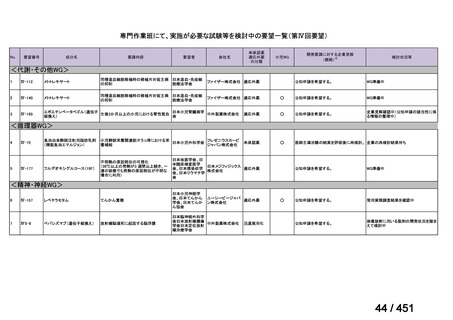
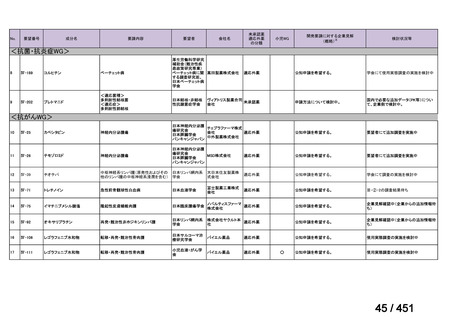
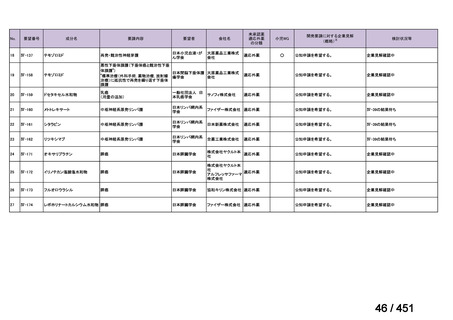
資料10
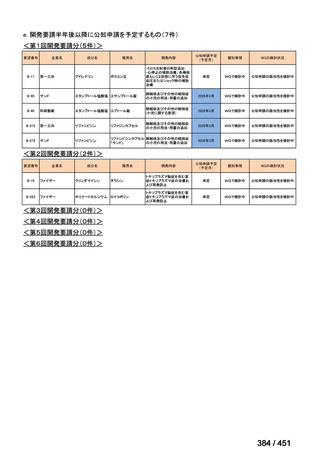
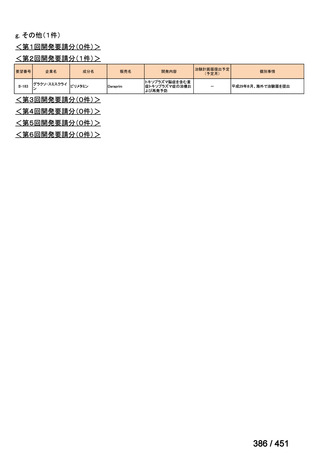
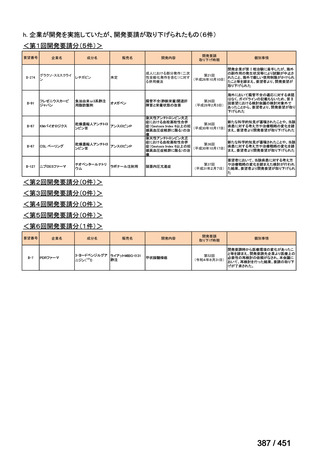
○日本・外国で承認を与えられている医薬品等と作用機序が明らかに異なる医薬品・医療機器・再生医療等製品を
「先駆的医薬品」等として指定する制度を法制化する。指定を受けた場合は優先審査等の対象となることを法律
上明確化する。
○小児用法用量が設定されていない医薬品など、医療上のニーズが著しく充足されていない医薬品等について、
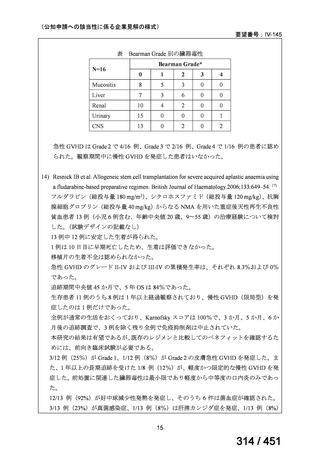
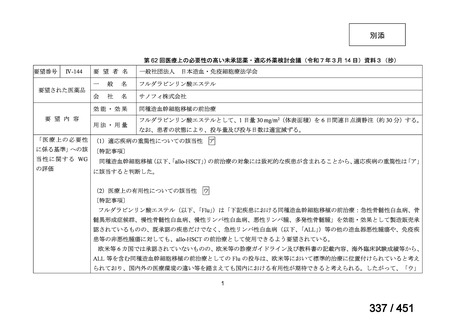
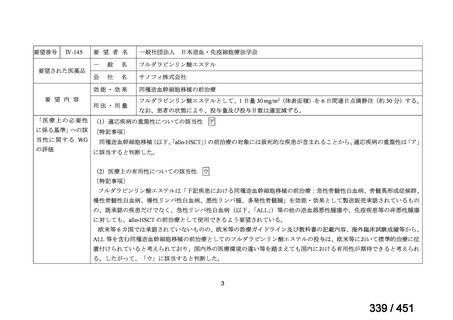
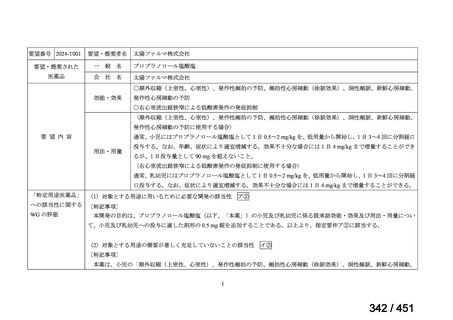
「特定用途医薬品」等として指定する制度を法制化する。指定を受けた場合は優先審査等の対象となることを法
律上明確化する。
○特定用途医薬品等については、現行の希少疾病用医薬品等と同様、試験研究を促進するための必要な資金の確保
及び税制上の措置を講じる(その特定の用途に係る患者数が少ないものに限る)ことを法律に規定する。
(※)税制優遇措置については、平成31年税制改正の大綱に既に位置づけられている。
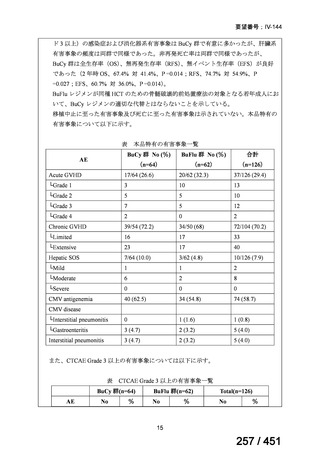
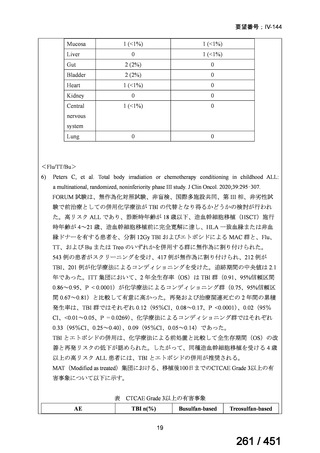
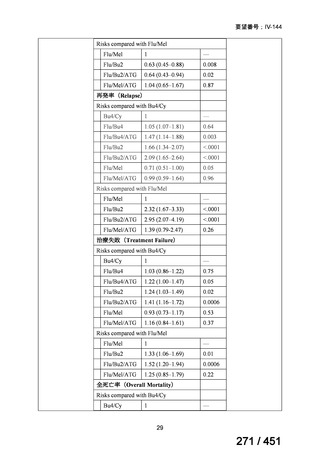
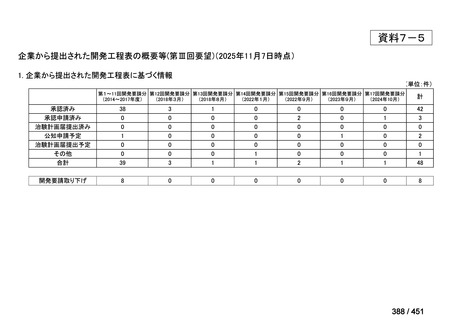
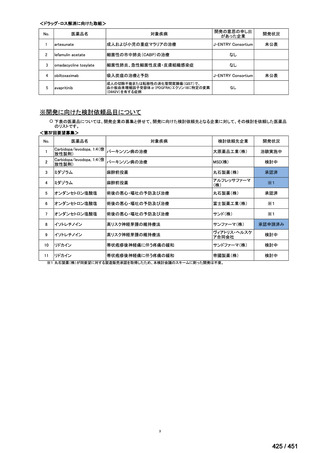
薬機法
改正前
医療上特に必要性が高い医薬品等
希少疾病用
医薬品等※
その他
先駆け指定
医薬品等
その他
運用で優先審査等の
対象として取扱い
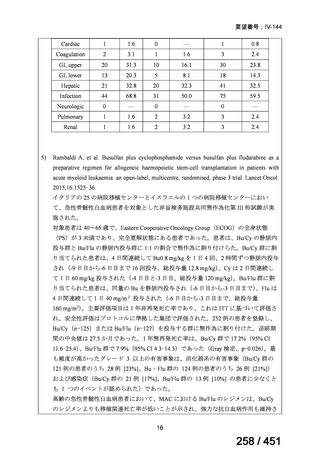
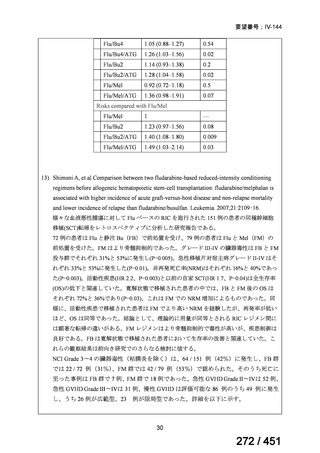
薬機法
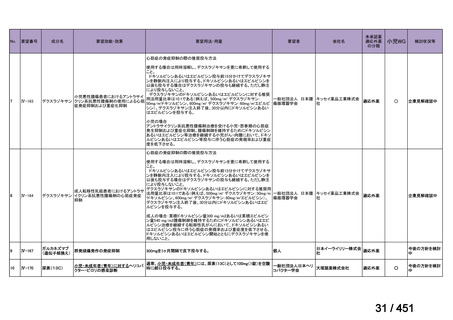
改正後
指定の要件
医療上特に必要性が高い医薬品等
希少疾病用
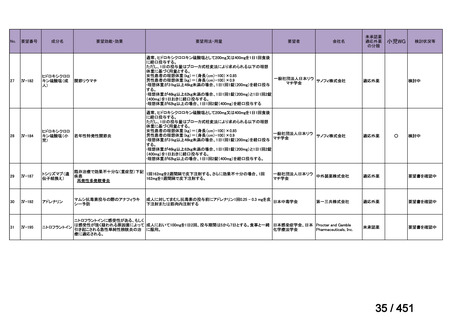
医薬品等※
先駆的
医薬品等
特定用途
医薬品等
優先審査等の
対象となる旨
法律上明確化
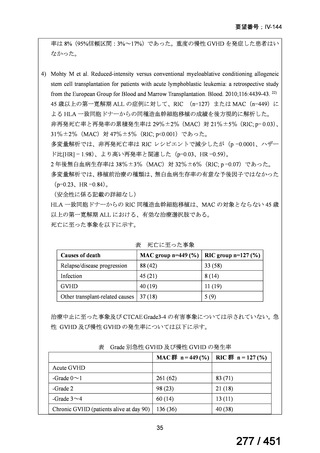
その他
(審査期間:12か月→6か月)
(※)本邦における対象患者が5万人未満又は指定難病
427 / 451
1