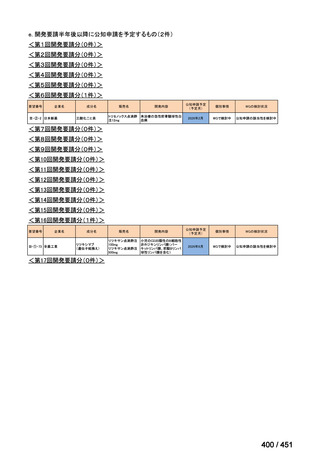
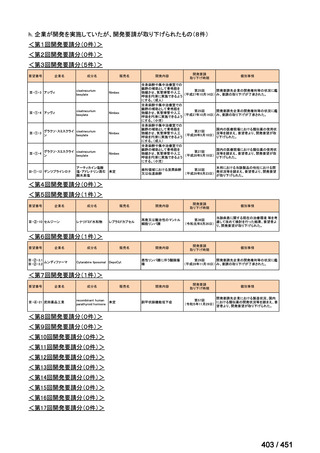
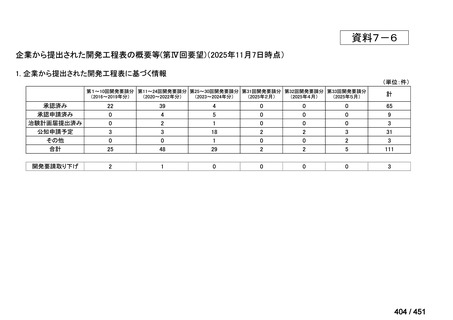
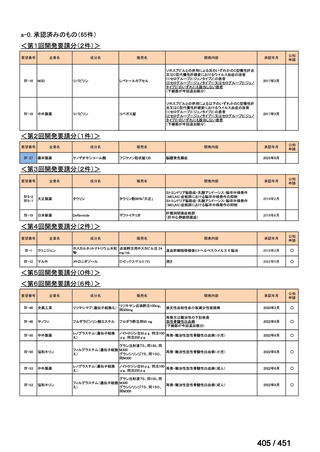
会議資料 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
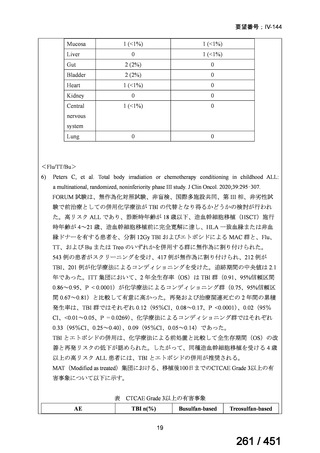
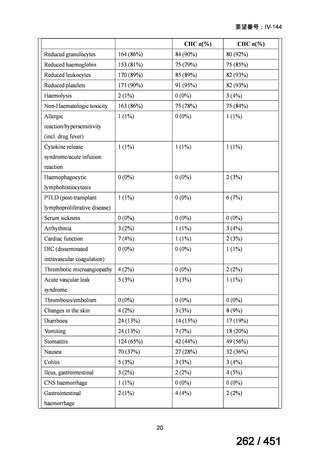
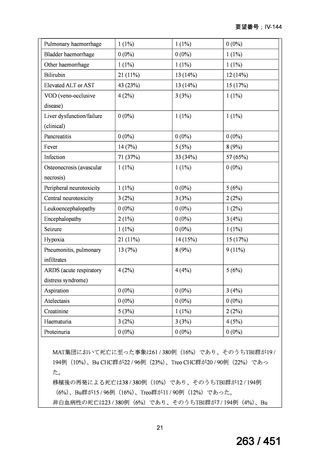
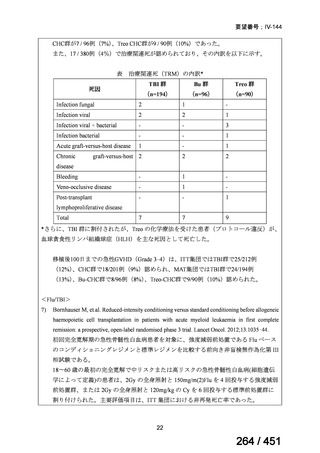
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
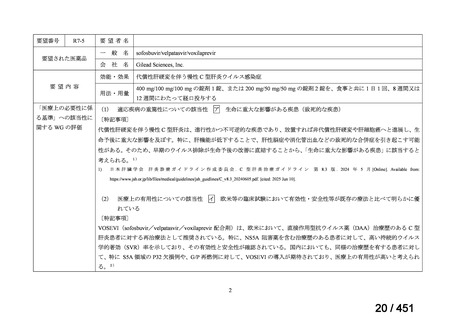
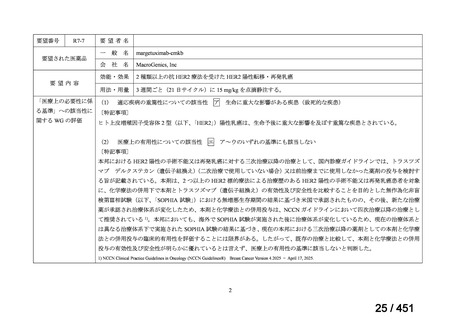
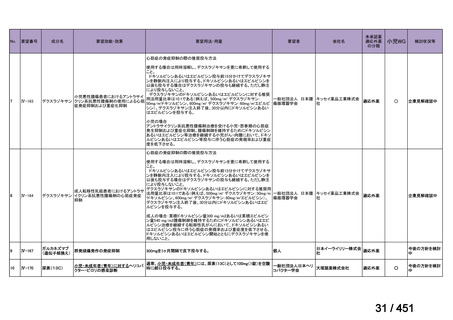
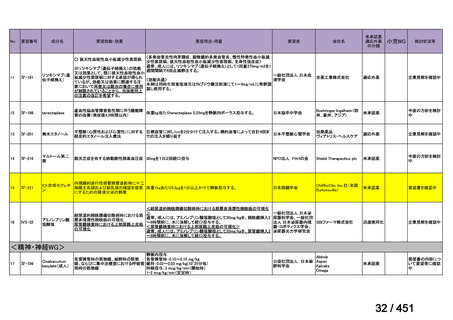
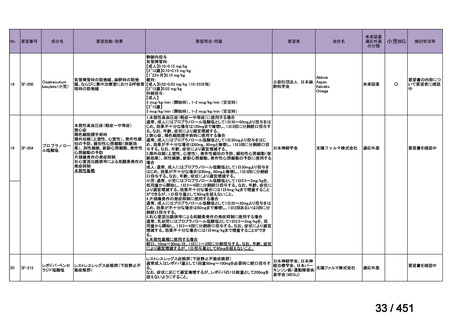
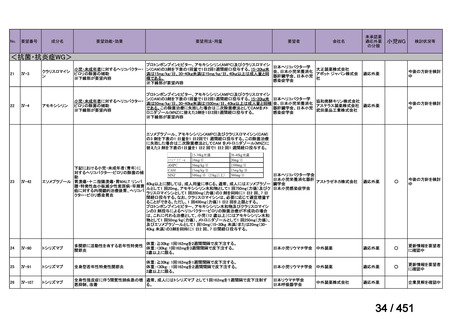
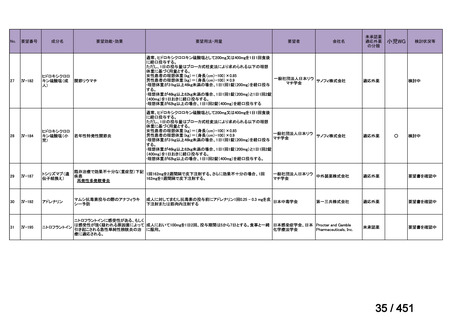
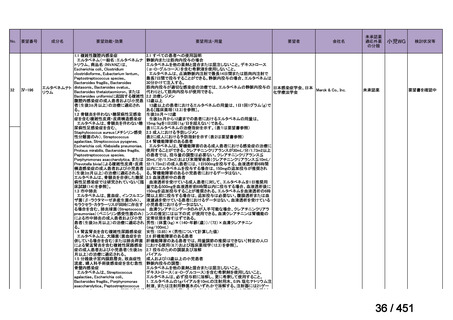
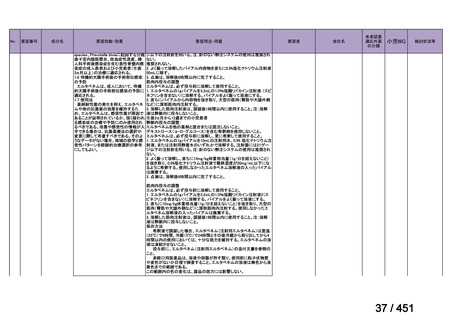
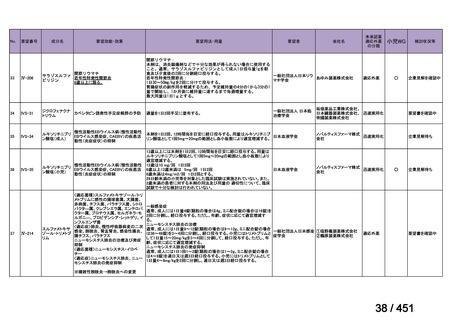
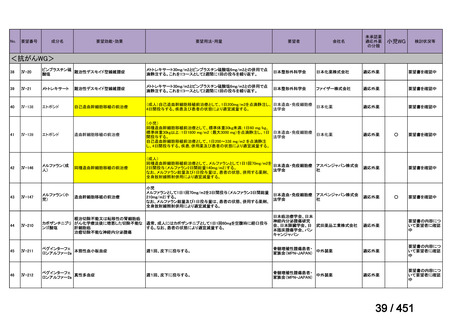
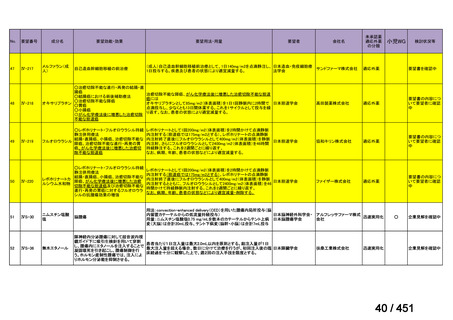
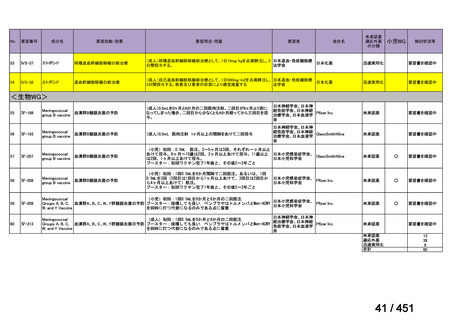
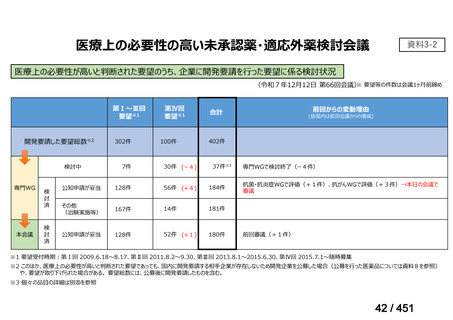
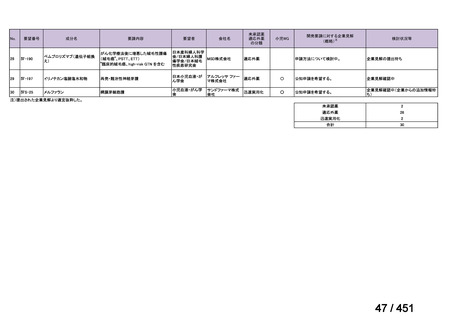
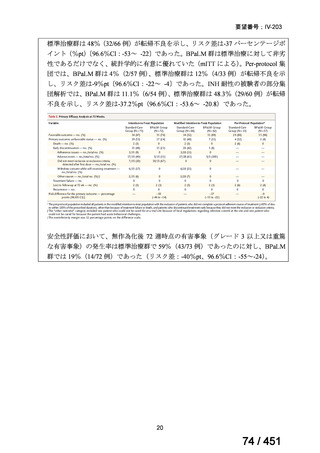
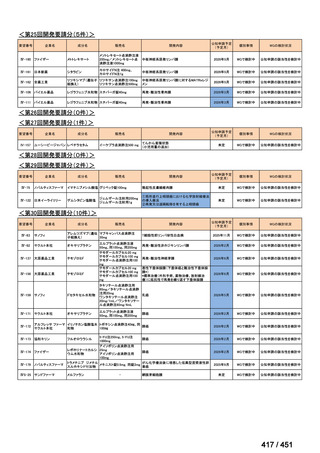
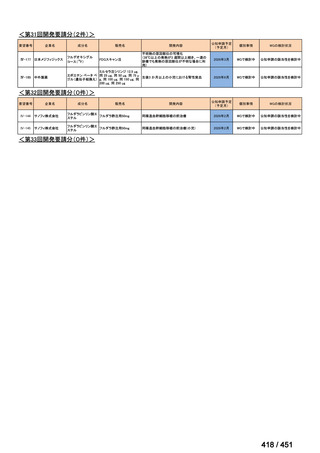
R7-7
要望された医薬品
要望者名
一
般
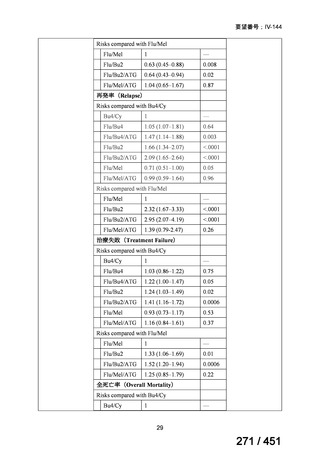
名
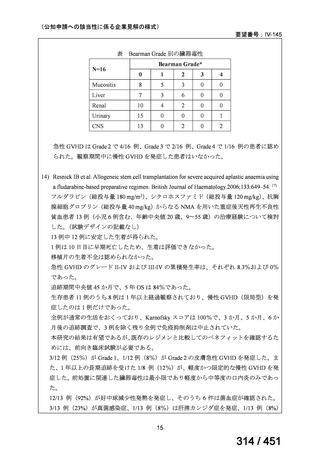
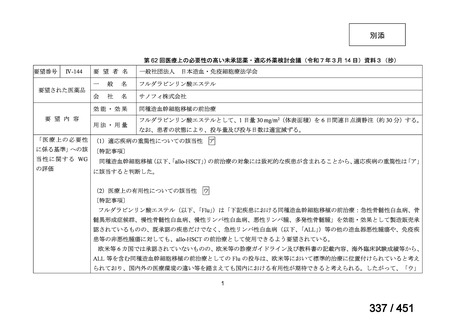
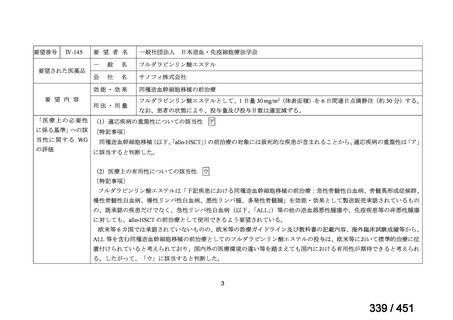
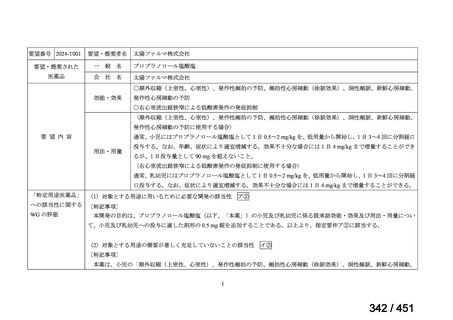
margetuximab-cmkb
会
社
名
MacroGenics, Inc
効能・効果
2 種類以上の抗 HER2 療法を受けた HER2 陽性転移・再発乳癌
用法・用量
3 週間ごと(21 日サイクル)に 15 mg/kg を点滴静注する。
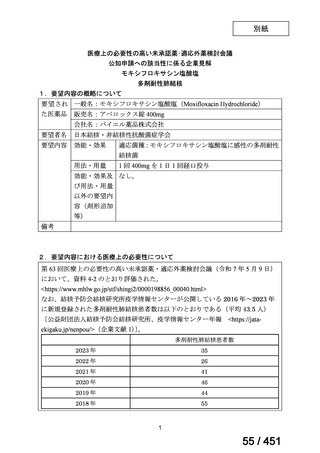
要望内容
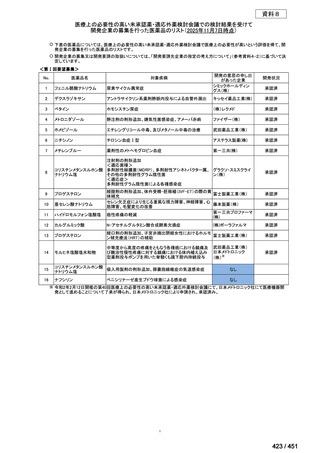
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
生命に重大な影響がある疾患(致死的な疾患)
ヒト上皮増殖因子受容体 2 型(以下、「HER2」)陽性乳癌は、生命予後に重大な影響を及ぼす重篤な疾患とされている。
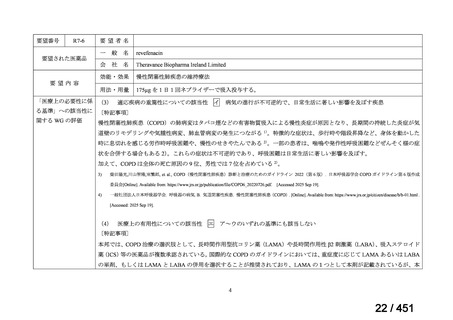
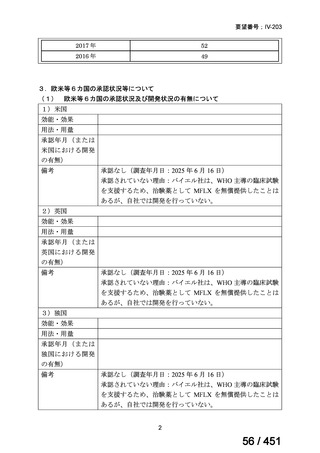
(2) 医療上の有用性についての該当性
エ
ア~ウのいずれの基準にも該当しない
〔特記事項〕
本邦における HER2 陽性の手術不能又は再発乳癌に対する三次治療以降の治療として、国内診療ガイドラインでは、トラスツズ
マブ デルクステカン(遺伝子組換え)
(二次治療で使用していない場合)又は前治療までに使用しなかった薬剤の投与を検討す
る旨が記載されている。本剤は、2 つ以上の HER2 標的療法による治療歴のある HER2 陽性の手術不能又は再発乳癌患者を対象
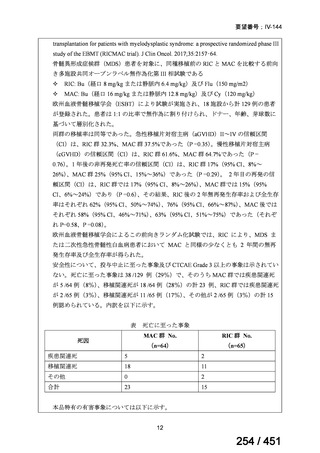
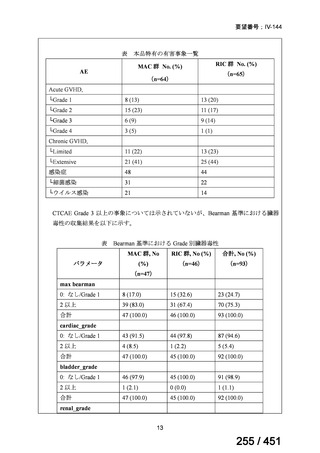
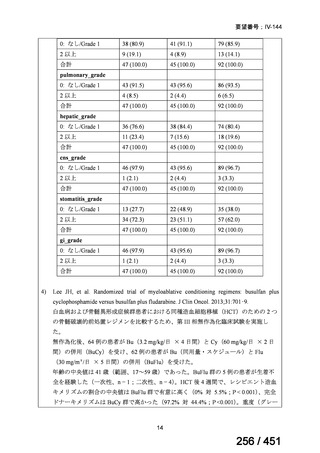
に、化学療法の併用下で本剤とトラスツズマブ(遺伝子組換え)の有効性及び安全性を比較することを目的とした無作為化非盲
検第Ⅲ相試験(以下、「SOPHIA 試験」
)における無増悪生存期間の結果に基づき米国で承認されたものの、その後、新たな治療
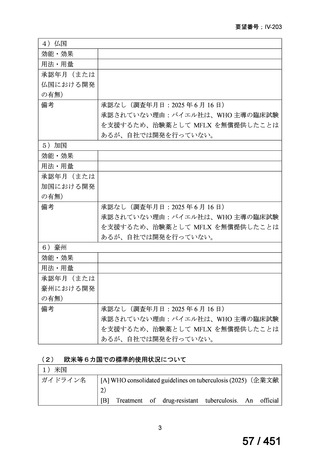
薬が承認され治療体系が変化したため、本剤と化学療法との併用投与は、NCCN ガイドラインにおいて四次治療以降の治療とし
て推奨されている 1)。本邦においても、海外で SOPHIA 試験が実施された後に治療体系が変化しているため、現在の治療体系と
は異なる治療体系下で実施された SOPHIA 試験の結果に基づき、現在の本邦における三次治療以降の薬剤としての本剤と化学療
法との併用投与の臨床的有用性を評価することには限界がある。したがって、既存の治療と比較して、本剤と化学療法との併用
投与の有効性及び安全性が明らかに優れているとは言えず、医療上の有用性の基準に該当しないと判断した。
1) NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Breast Cancer Version 4.2025 — April 17, 2025.
2
25 / 451