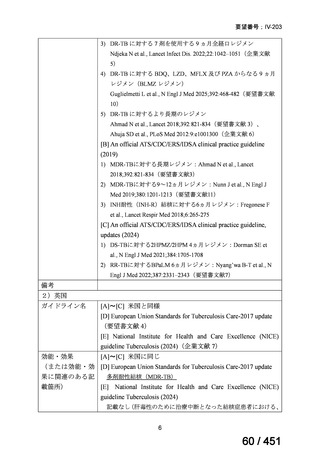
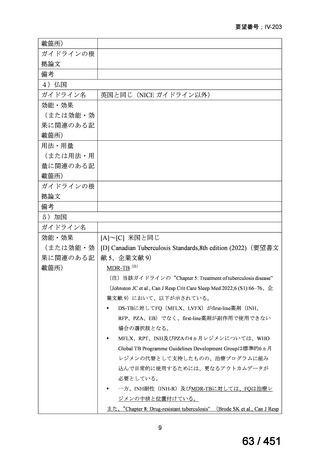
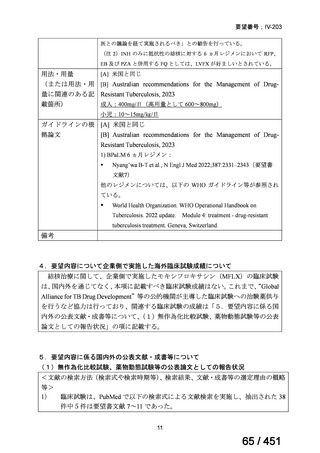
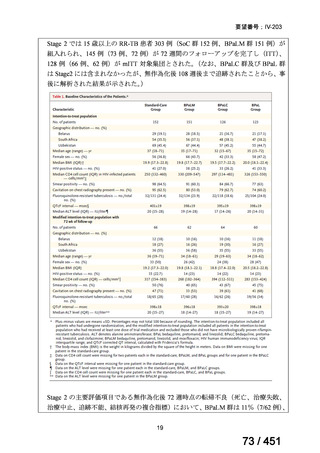
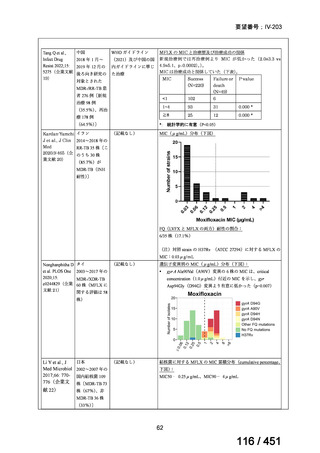
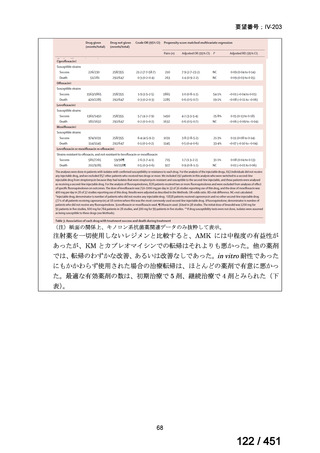
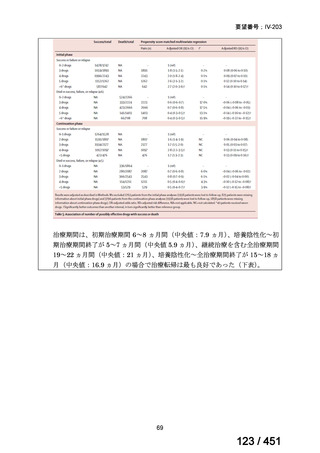
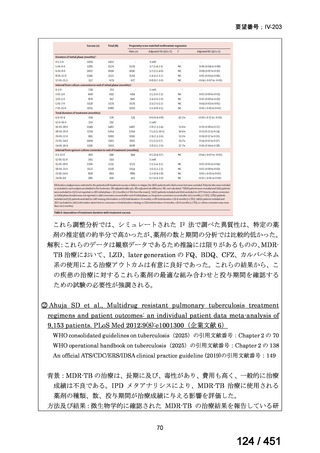
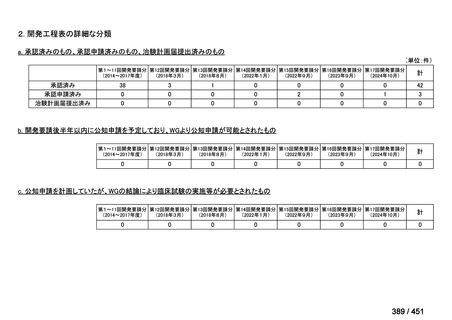
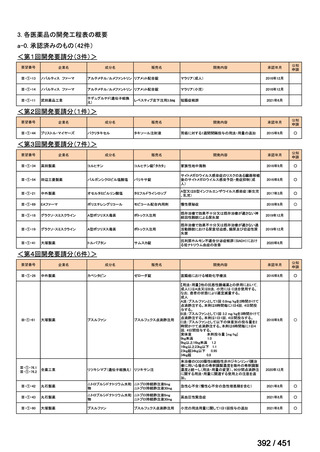
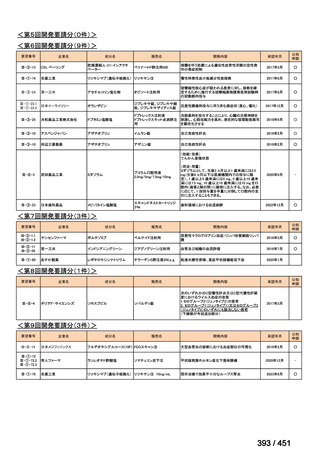
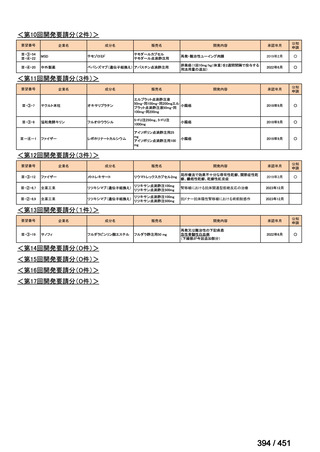
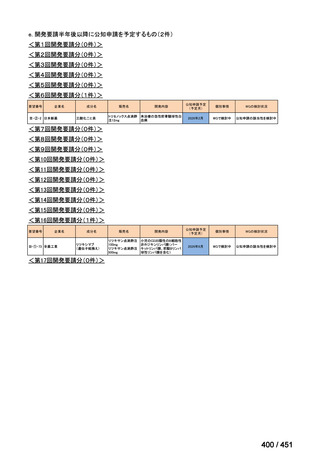
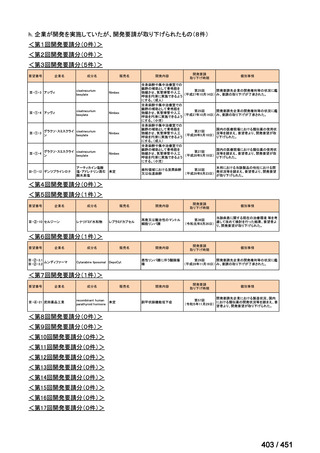
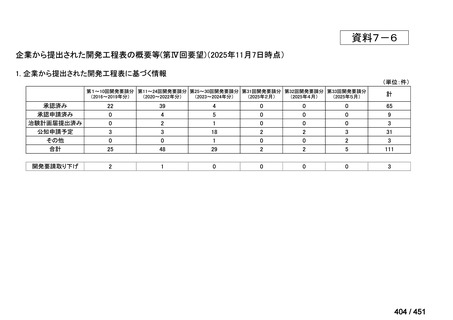
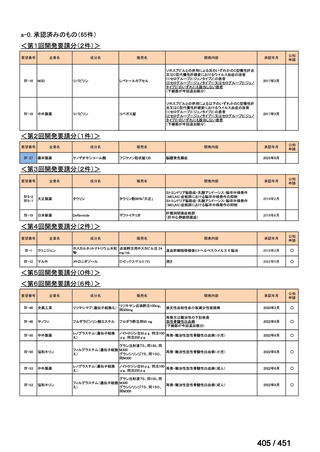
会議資料 (196 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
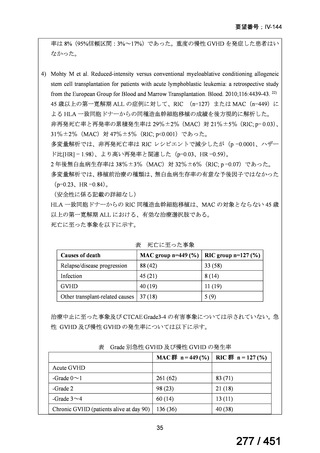
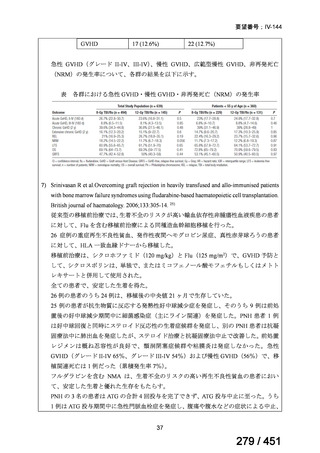
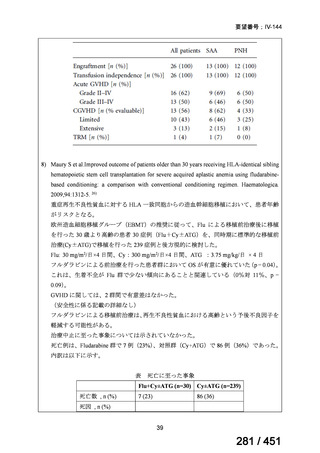
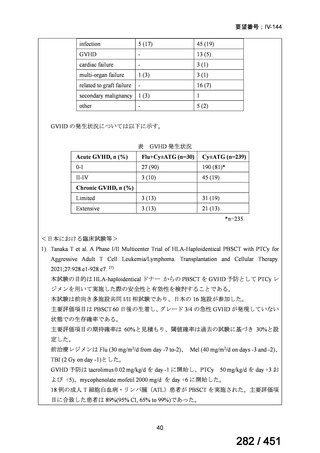
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
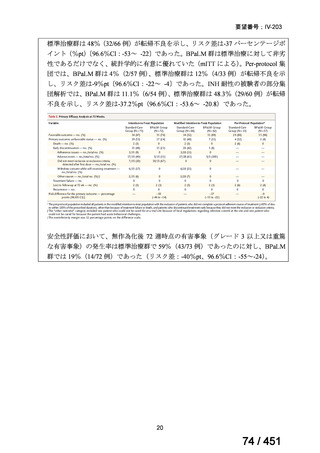
既承認効能・効果における承認用量は 400mg であり、それを超える用量の安全性は
確認されていないことや、中国人 MDR-TB 患者での QTc 延長の閾値となる曝露量
(企業文献 12)が国内第Ⅰ相試験において MFLX400mg/日 5~14 日間反復投与で
達成された曝露量と大きく異ならず、日本人 MDR-TB 患者に対して 400mg/日を超
える用量で MFLX を投与することの必要性は乏しいと考えられることから、本剤の
MDR-TB 治療における用量は、既承認効能・効果と同様に 400mg とすることが適
切であると考える。また、小児用量として 10~15mg/kg/日が一部のガイドラインで
推奨されているが、エビデンスが十分であるとは言い難く、国内の用法・用量に含
めるべきではないと考える。
投与期間については、新規抗結核薬の開発・承認や、結核症治療に関するエビデ
ンスの蓄積により、推奨される薬剤の組み合わせや投与期間が変化する可能性があ
ること、及び投与期間は併用薬の種類や個々の患者の病態等をもとに判断されるも
のと考えるため、本剤の投与期間を具体的に規定することは困難と考える。
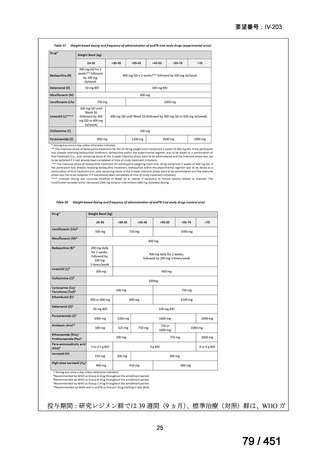
したがって、MDR-TB 治療における本剤の用法・用量は、既承認用法・用量であ
る「通常、成人にはモキシフロキサシンとして、1 回 400mg を 1 日 1 回経口投与す
る。」とすることが適切と考える。
また、
「用法及び用量に関連する注意」のうち、本剤の既承認効能・効果共通の注
意として現行の添付文書に示されている「体重が 40kg 未満の患者では、低用量
(200mg)を用いるなど慎重に投与すること。」については、MDR-TB における低用
量の有効性が確認されていないことから、MDR-TB は当該注意の対象外とすること
が適切と考える。
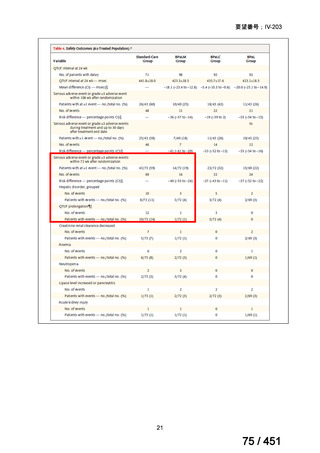
なお、本薬を経口または静脈内投与され、2025 年 9 月 12 日までに Bayer AG の安
全性データベースに登録された 50,355 例の成人患者のうち、体重が 40kg 未満の患
者は 348 例含まれ、その投与量は 200mg/日が 3 例、400mg/日が 241 例、800mg/日
が 1 例であり、103 例では 1 日あたりの投与量が報告されていなかった。体重が
40kg 未満の患者のうち、国内の症例は 41 例含まれ、その投与量は 200mg/日が 2 例、
400mg/日が 22 例であり、17 例では 1 日あたりの投与量が報告されていなかった。
これらの全体集団と体重 40kg 未満の部分集団の安全性プロファイルを比較したと
ころ、発現した有害事象の種類及び発現割合は類似していたことから、本薬 400mg
を MDR-TB 患者に投与したときのベネフィット・リスクバランスは、患者の体重が
40kg 未満であっても影響を受けないと考えられる。
加えて、MDR-TB の治療においては複数の抗結核薬を併用することが原則である
ことから、添付文書の「7.用法及び用量に関連する注意」に以下を追記することが
適切と考える。
【用法・用量に関連する使用上の注意】(今回の要望に関連する部分のみ抜粋)
〈多剤耐性肺結核〉
142
196 / 451