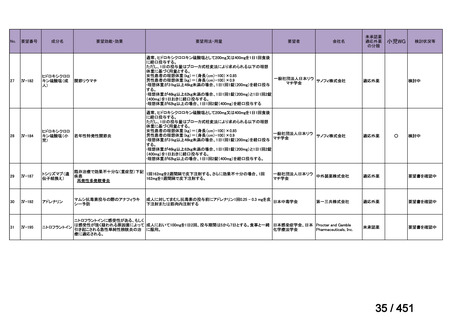
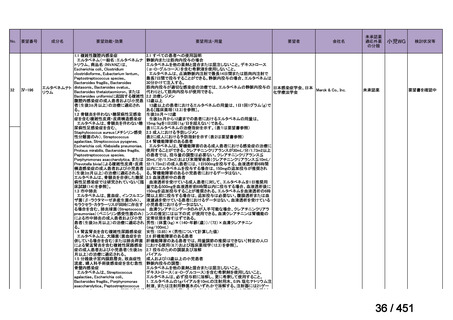
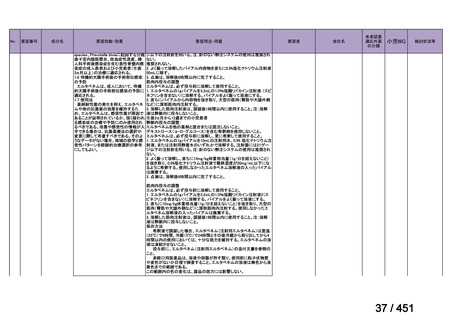
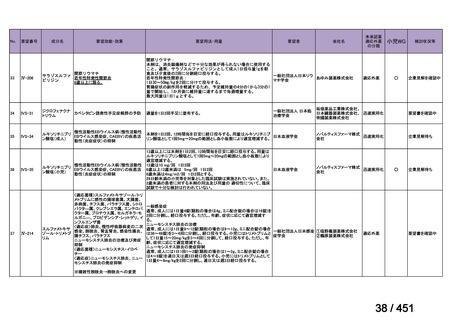
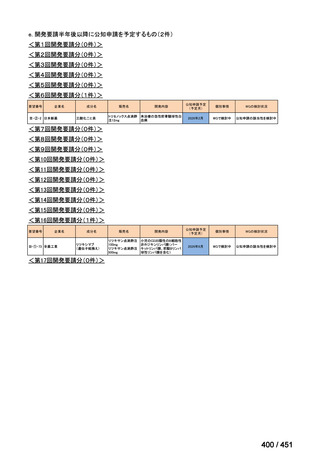
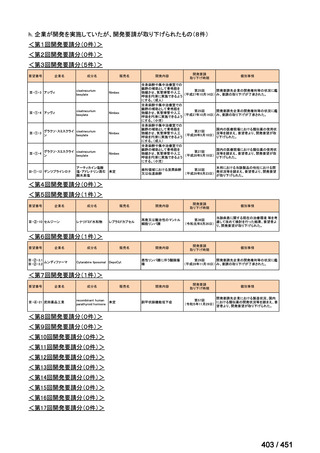
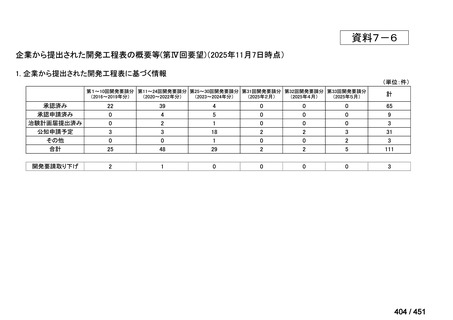
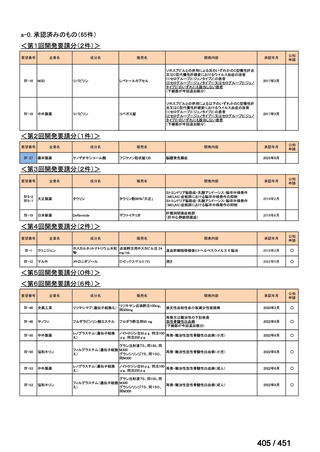
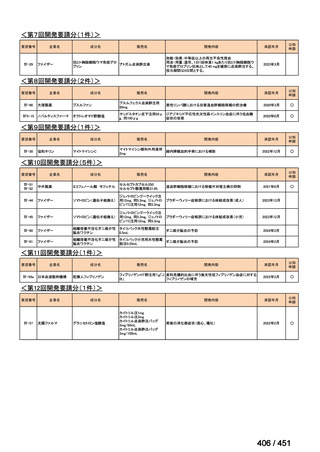
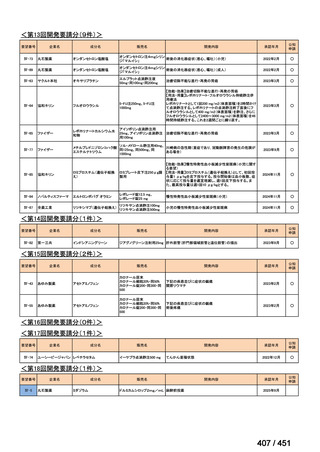
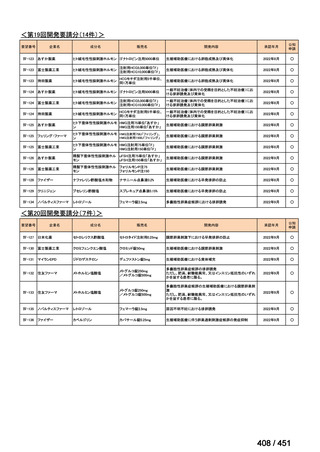
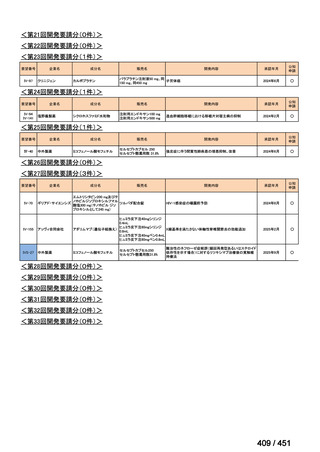
会議資料 (203 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
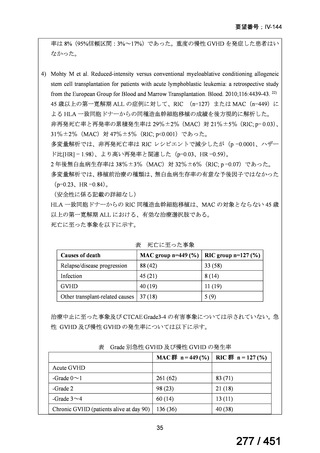
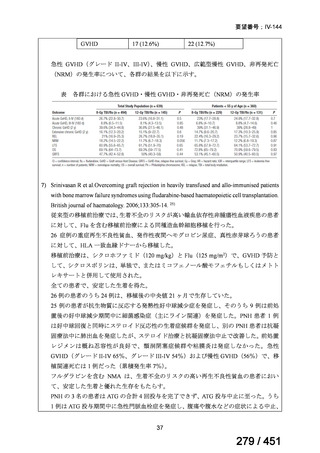
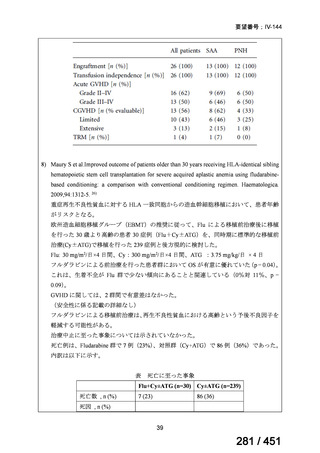
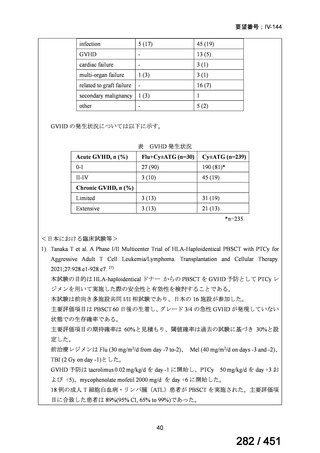
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
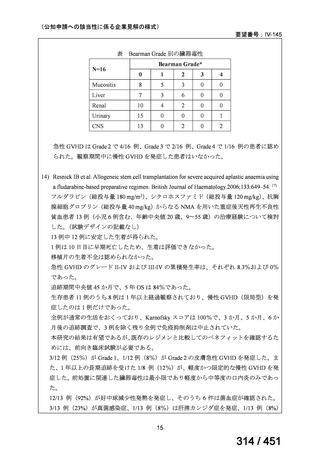
る。
2.要望内容における医療上の必要性について
第 59 回「医療上の必要性の高い未承認薬・適応外薬検討会議」(令和 6 年 7 月 5 日)に
おいて、別添のとおり医療上の必要性の基準に該当すると判断した。なお、
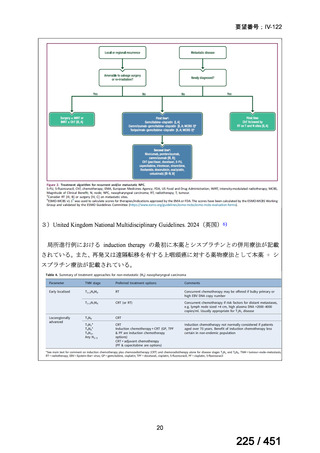
「局所進行上
咽頭癌に対する補助化学療法」について医療上の有用性が期待できるのは「局所進行上咽
頭癌に対する導入化学療法」に限定されると判断された。
3.公知申請の妥当性について
企業見解を提出した企業は、公知申請の妥当性について、下記のとおり説明している。
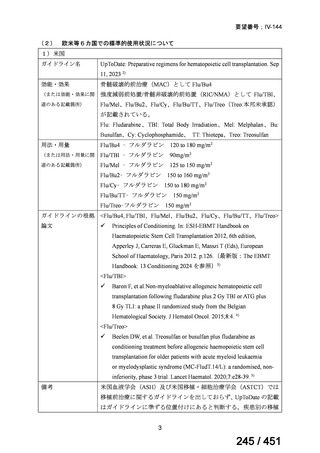
有効性について、海外第Ⅱ相試験及び海外第Ⅲ相試験、並びに後方視的調査(別紙 1 の
企業見解、p9~13)、国内の後方視的調査(別紙 1 の企業見解、p22)、国内外の教科書、
診療ガイドラインから、①局所進行上咽頭癌患者に対する化学放射線療法の導入療法
としてのゲムシタビン(以下、
「GEM」)とシスプラチンとの併用(以下、
「GP」)投与、
並びに②再発又は遠隔転移を有する上咽頭癌患者に対する GEM と白金系抗悪性腫瘍
剤との併用投与及び GEM 単独投与の有効性は期待できる。
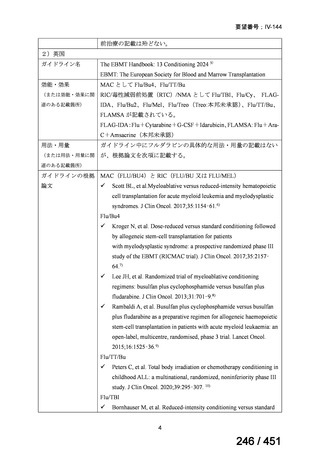
安全性について、海外第Ⅱ相試験及び海外第Ⅲ相試験、並びに後方視的調査(別紙 1 の
企業見解、p9~13)、国内の後方視的調査(別紙 1 の企業見解、p22)より、①局所進
行上咽頭癌患者に対する化学放射線療法の導入療法としての GP 投与、並びに②再発
又は遠隔転移を有する上咽頭癌に対する GEM と白金系抗悪性腫瘍剤との併用投与及
び GEM 単独投与において認められた主な有害事象は各薬剤で既知の有害事象であり、
新たな安全性上の懸念は認められなかった。
以上より、
①局所進行上咽頭癌患者に対する化学放射線療法の導入療法としての GP 投
与、並びに②再発又は遠隔転移を有する上咽頭癌患者に対する GEM と白金系抗悪性
腫瘍剤との併用投与及び GEM 単独投与の有用性は医学薬学上公知である。
医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」)は、上記の企業
見解を提出した企業の有効性及び安全性に係る説明に加え、要望者により実施された国内
使用実態調査(別紙 2 の国内使用実態調査結果)より、以下の点を確認した。
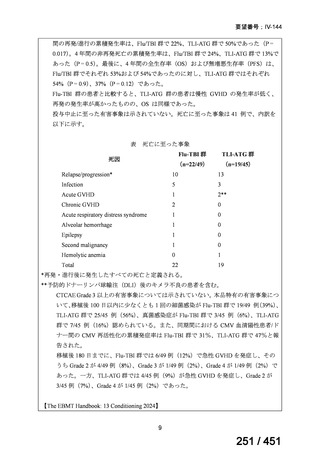
局所進行上咽頭癌患者に対する化学放射線療法の導入療法としての GP 投与の国内使
用実態が認められ、奏効等の一定の有効性が確認されたこと
再発又は遠隔転移を有する上咽頭癌患者に対する GEM とカルボプラチンとの併用投
与に係る国内使用実態が認められたこと
以上より、検討会議は、①局所進行上咽頭癌患者に対する化学放射線療法の導入療法と
2
203 / 451