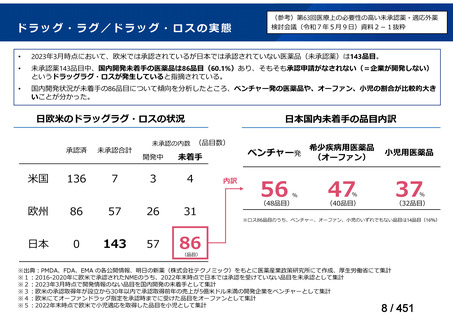
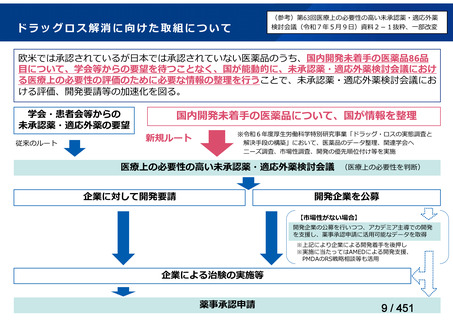
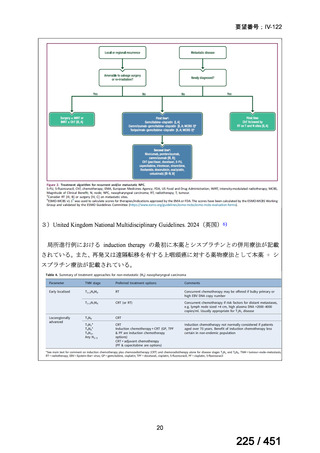
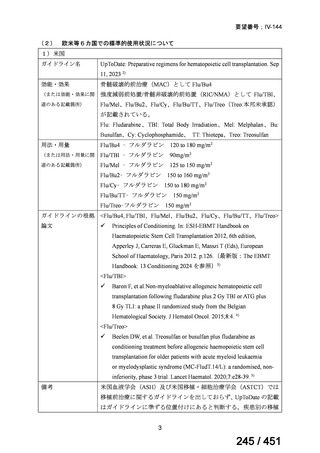
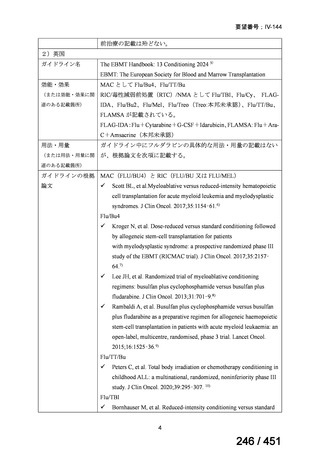
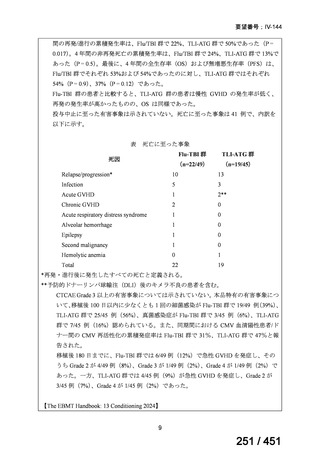
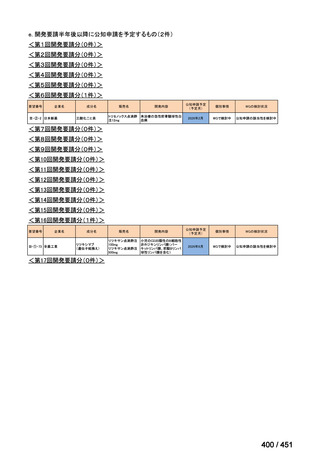
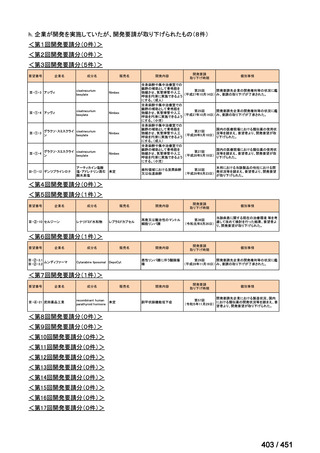
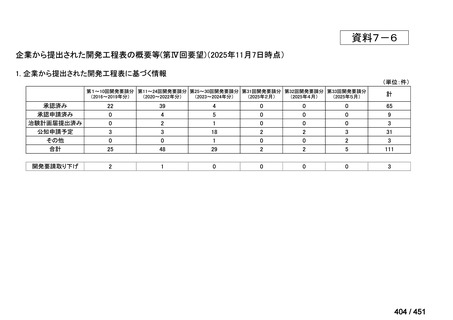
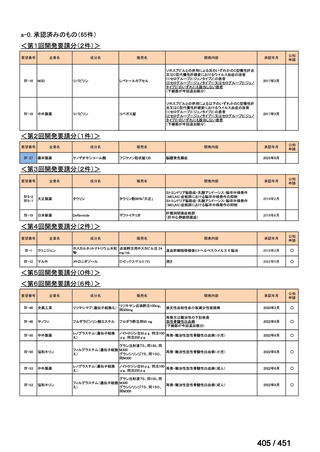
会議資料 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
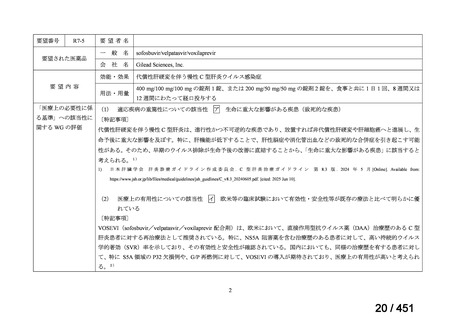
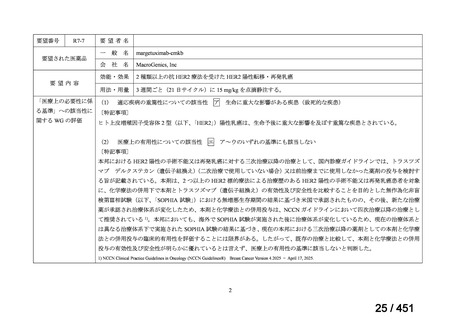
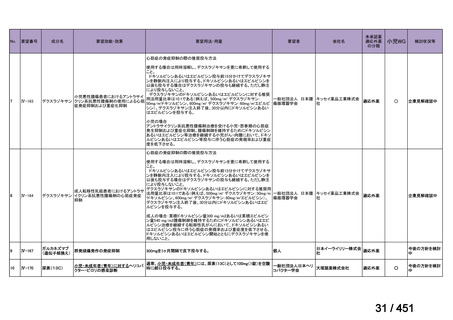
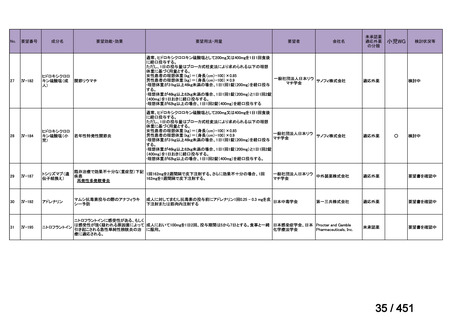
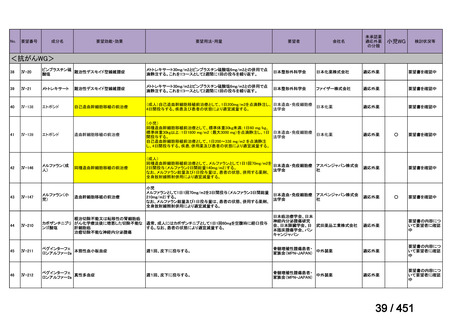
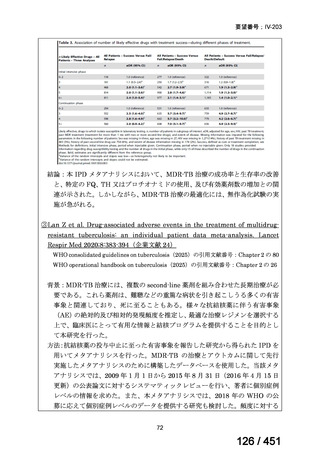
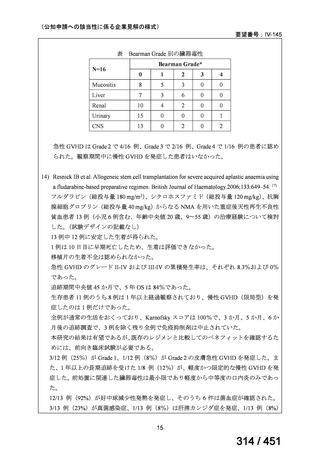
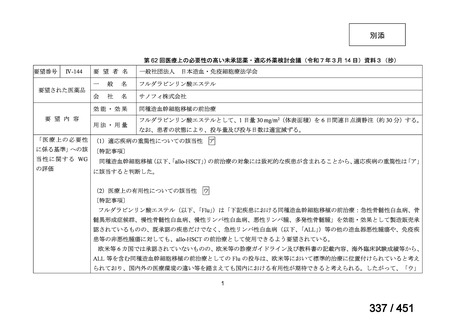
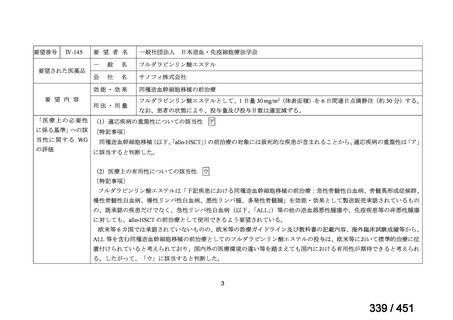
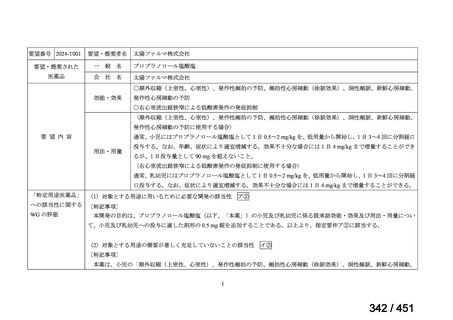
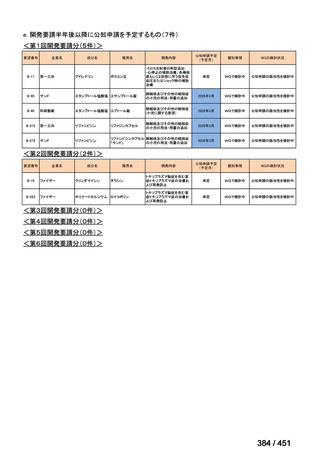
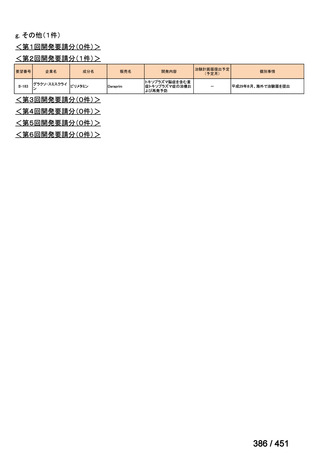
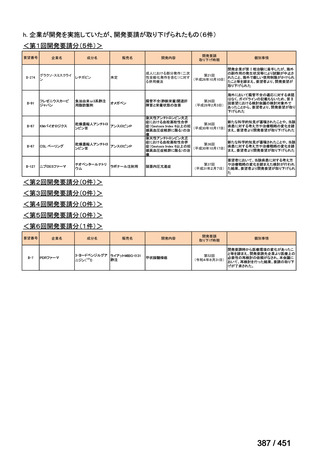
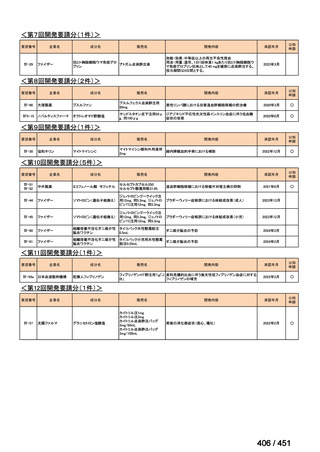
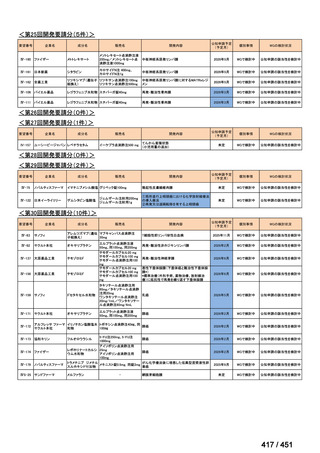
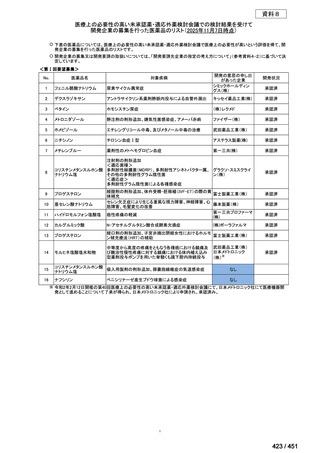
R7-5
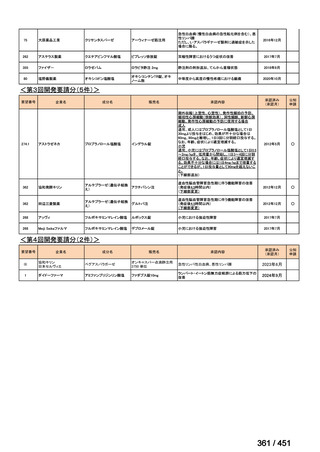
要望された医薬品
要望者名
一
般
名
sofosbuvir/velpatasvir/voxilaprevir
会
社
名
Gilead Sciences, Inc.
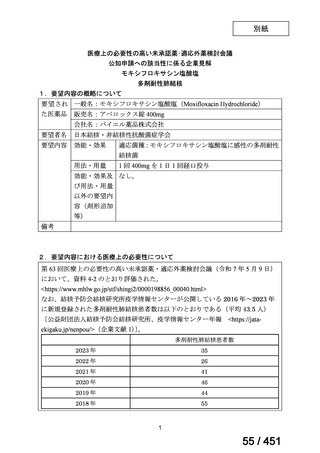
効能・効果
要望内容
用法・用量
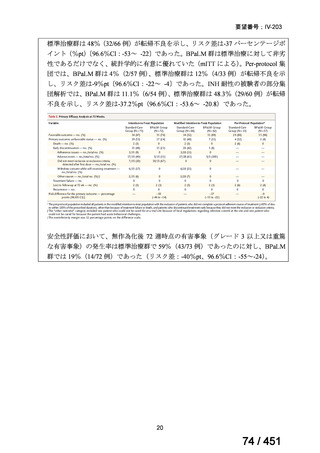
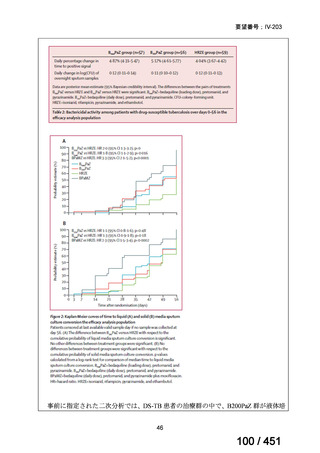
代償性肝硬変を伴う慢性 C 型肝炎ウイルス感染症
400 mg/100 mg/100 mg の錠剤 1 錠、または 200 mg/50 mg/50 mg の錠剤 2 錠を、食事と共に 1 日 1 回、8 週間又は
12 週間にわたって経口投与する
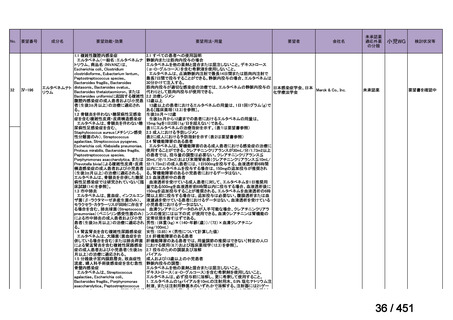
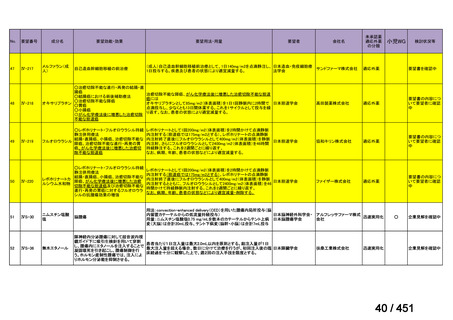
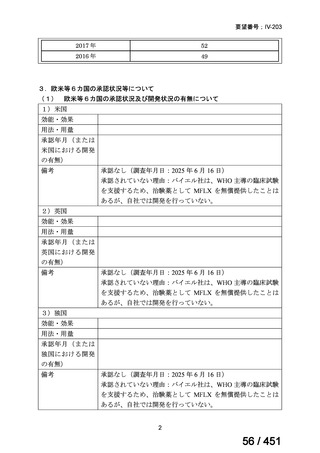
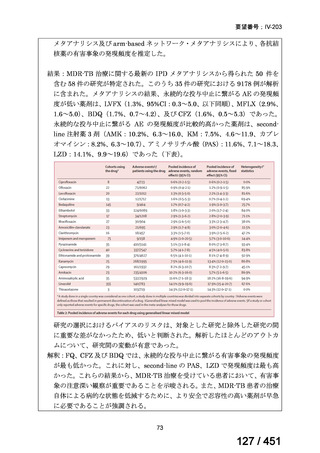
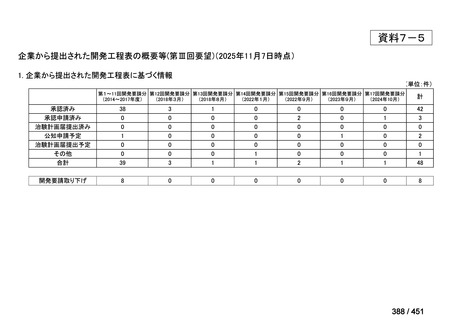
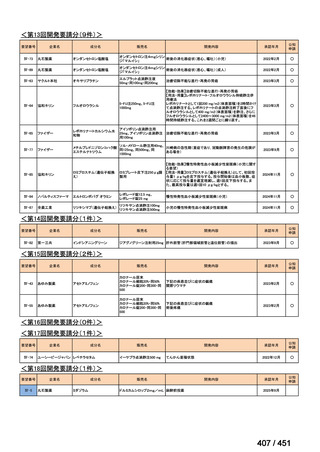
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
生命に重大な影響がある疾患(致死的な疾患)
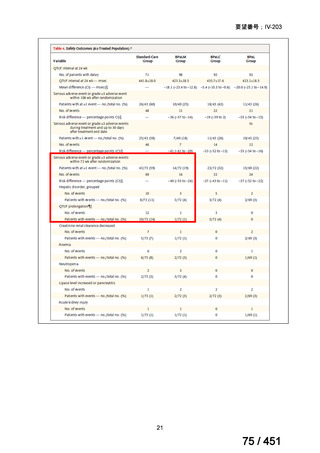
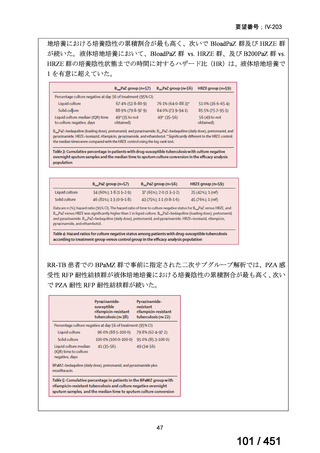
代償性肝硬変を伴う慢性 C 型肝炎は、進行性かつ不可逆的な疾患であり、放置すれば非代償性肝硬変や肝細胞癌へと進展し、生
命予後に重大な影響を及ぼす。特に、肝機能が低下することで、肝性脳症や消化管出血などの致死的な合併症を引き起こす可能
性がある。そのため、早期のウイルス排除が生命予後の改善に直結することから、
「生命に重大な影響がある疾患」に該当すると
考えられる。1)
1)
日本肝臓学会
肝炎診療ガイドライン作成委員会. C 型肝炎治療ガイドライン
第 8.3 版 . 2024 年 5 月 [Online]. Available from:
https://www.jsh.or.jp/lib/files/medical/guidelines/jsh_guidlines/C_v8.3_20240605.pdf. [cited: 2025 Jun 10].
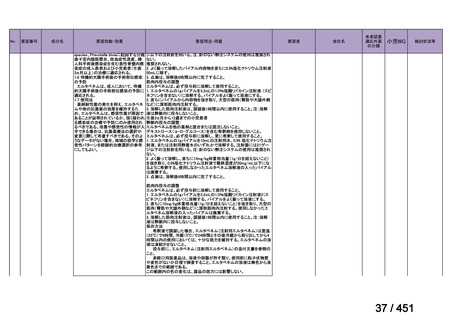
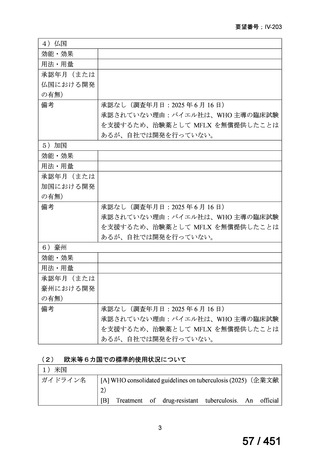
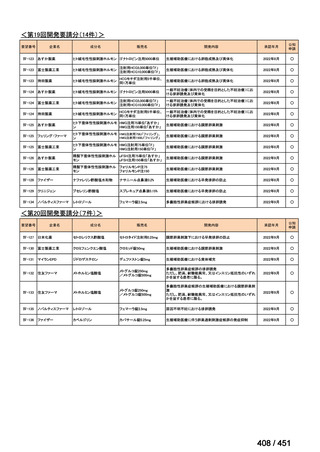
(2) 医療上の有用性についての該当性
イ
欧米等の臨床試験において有効性・安全性等が既存の療法と比べて明らかに優
れている
〔特記事項〕
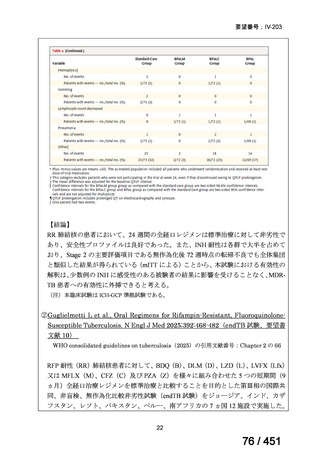
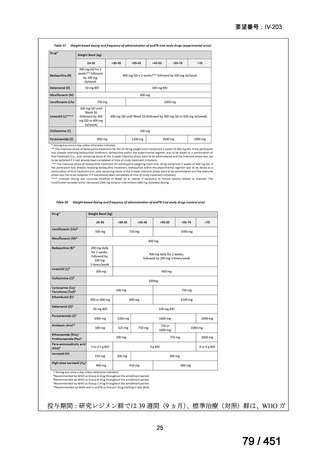
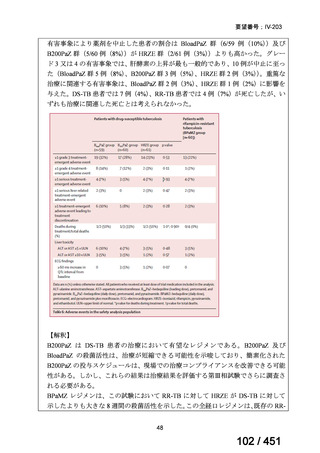
VOSEVI(sofosbuvir/velpatasvir/voxilaprevir 配合剤)は、欧米において、直接作用型抗ウイルス薬(DAA)治療歴のある C 型
肝炎患者に対する再治療法として推奨されている。特に、NS5A 阻害薬を含む治療歴のある患者に対して、高い持続的ウイルス
学的著効(SVR)率を示しており、その有効性と安全性が確認されている。国内においても、同様の治療歴を有する患者に対し
て、特に S5A 領域の P32 欠損例や、G/P 再燃例に対して、VOSEVI の導入が期待されており、医療上の有用性が高いと考えられ
る。2)
2
20 / 451