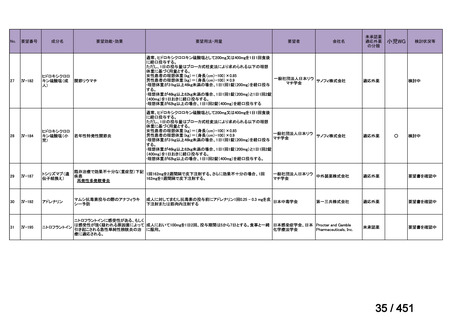
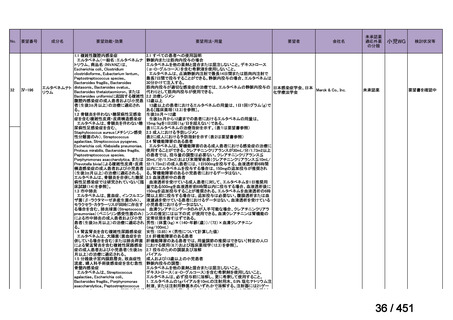
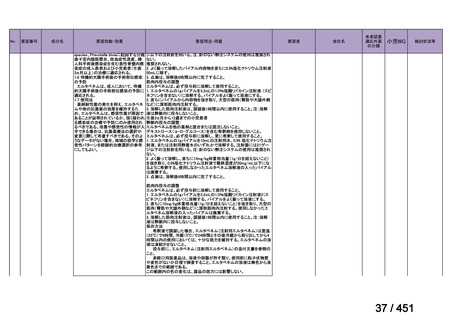
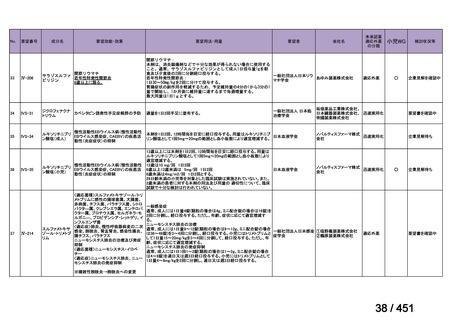
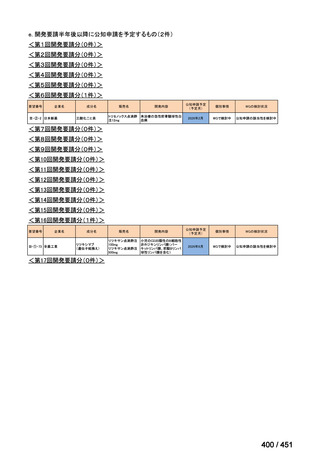
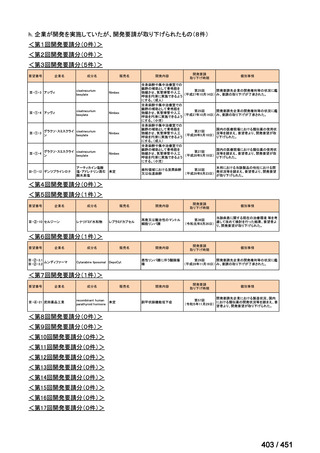
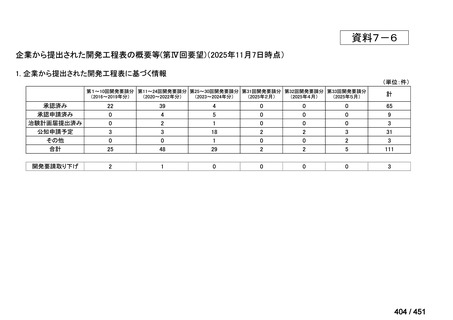
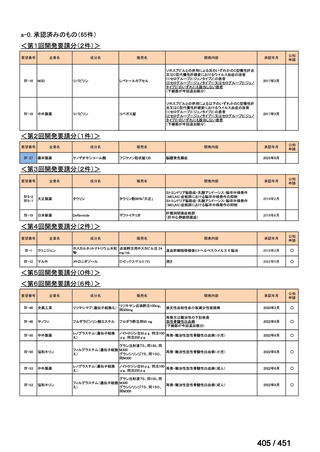
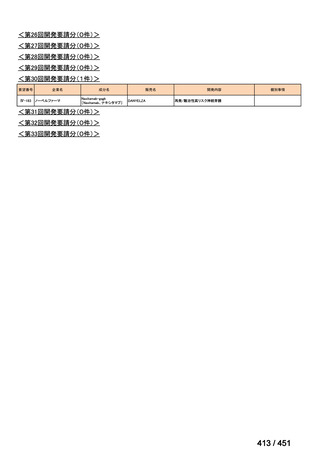
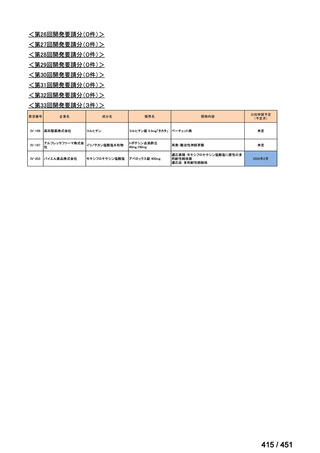
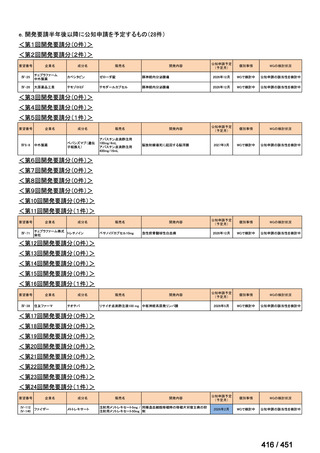
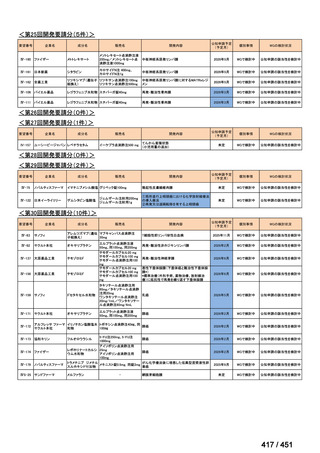
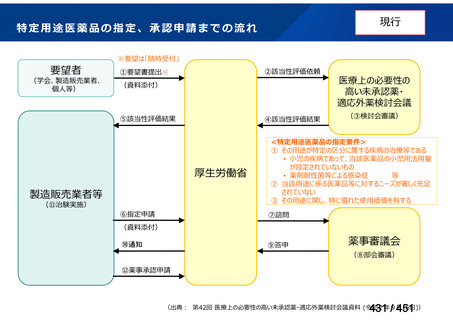
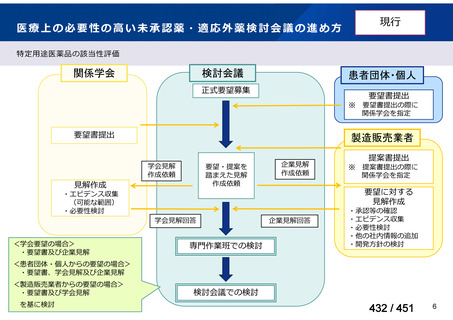
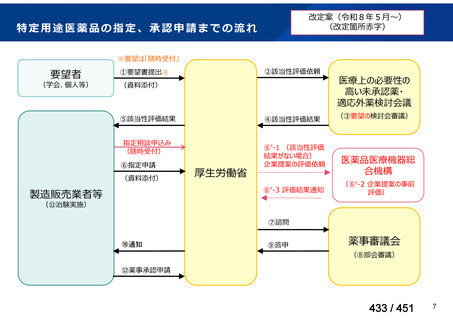
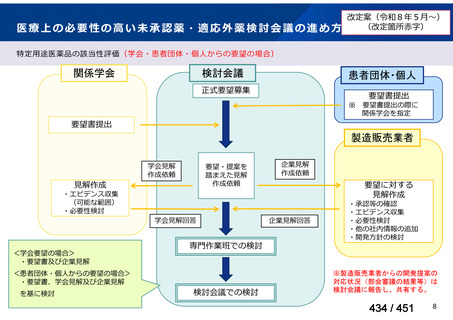
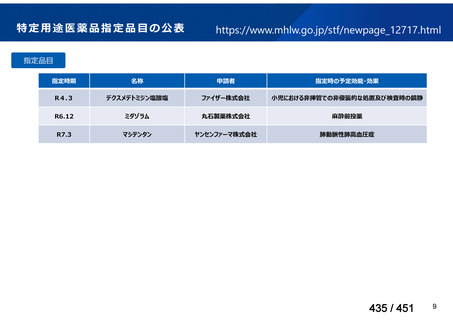
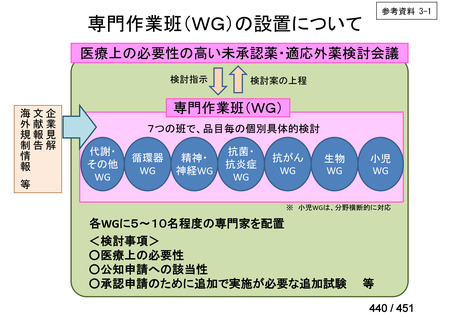
会議資料 (113 ページ)
出典
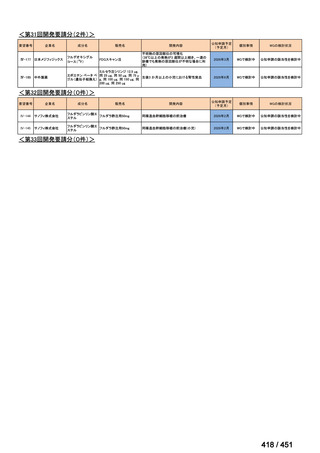
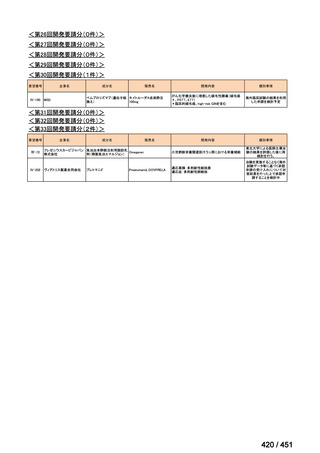
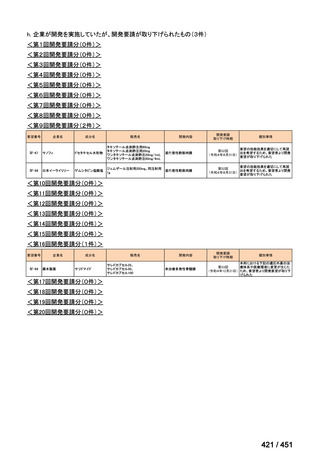
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
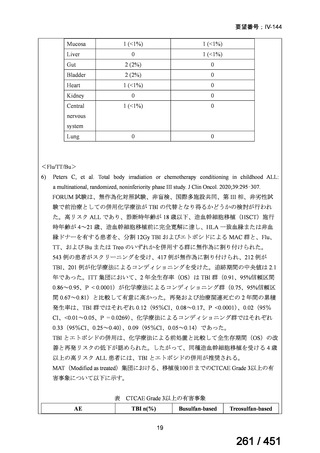
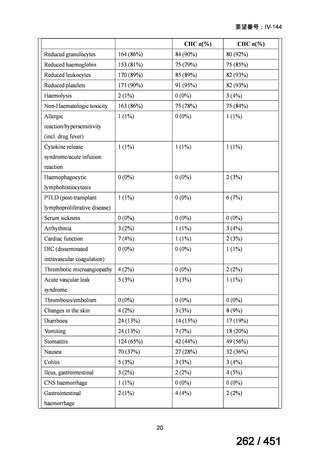
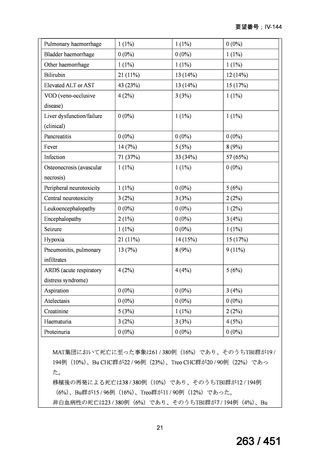
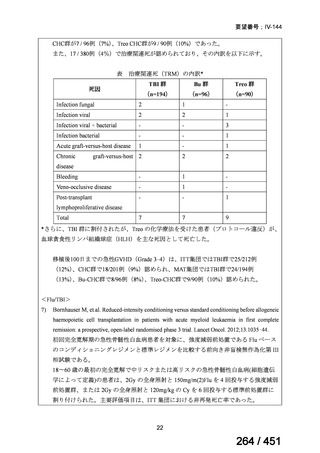
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
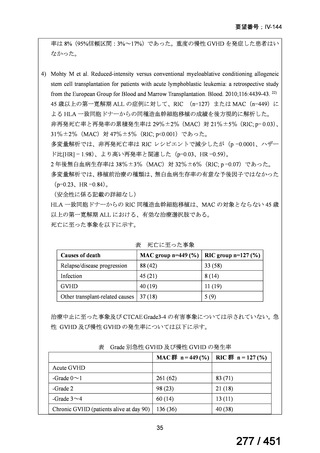
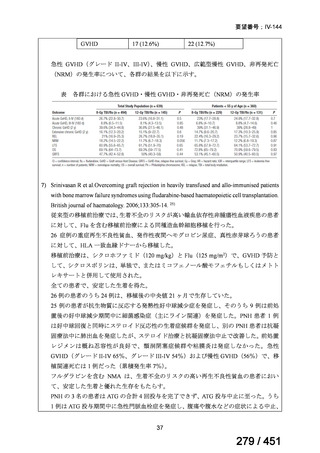
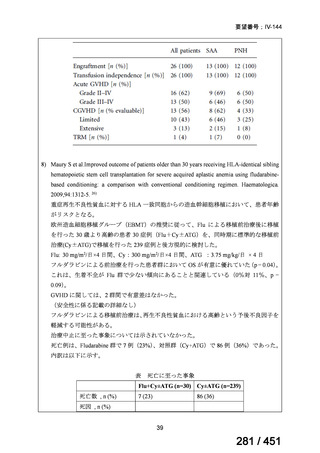
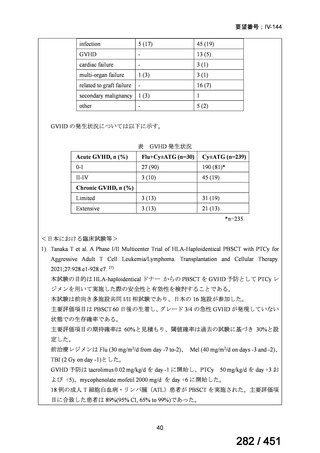
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
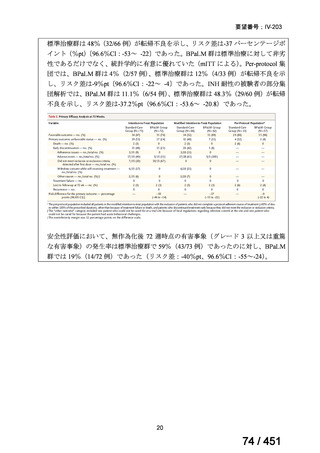
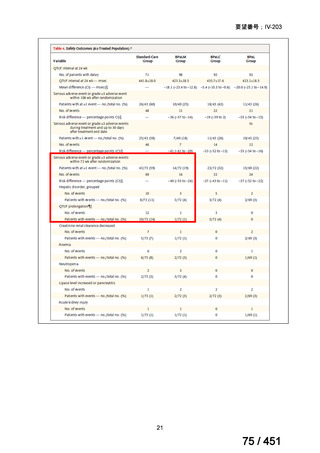
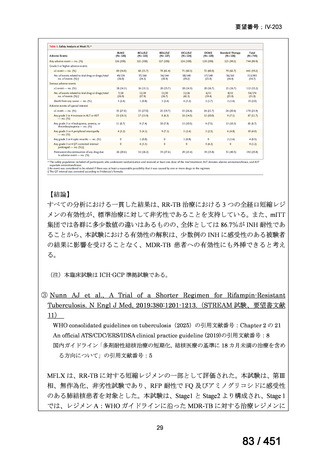
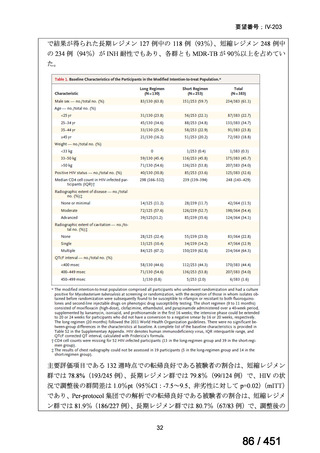
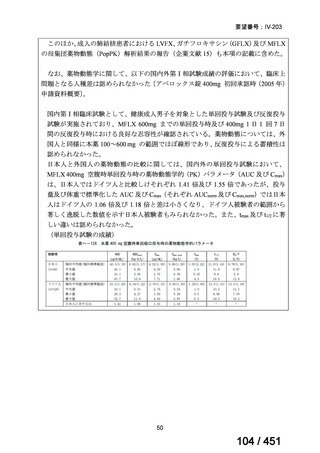
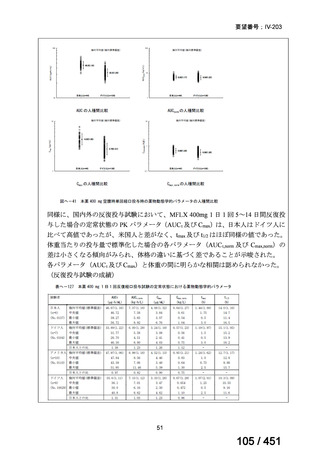
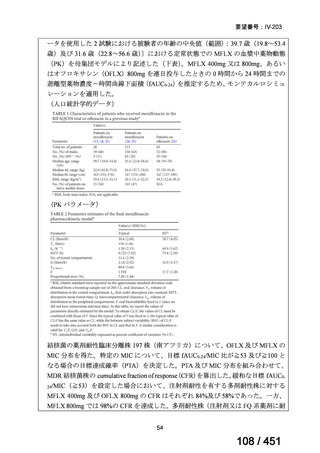
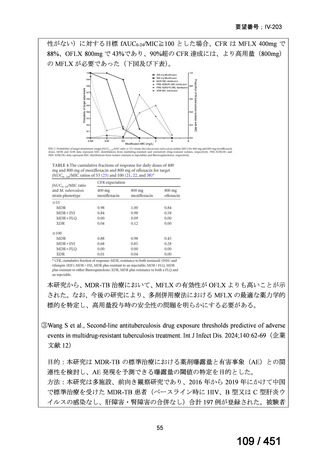
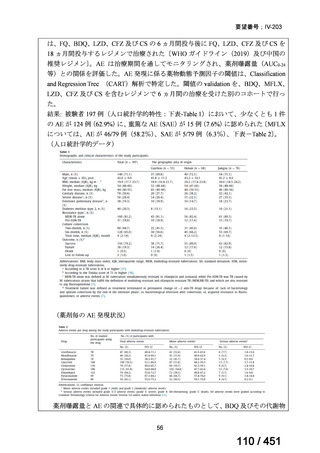
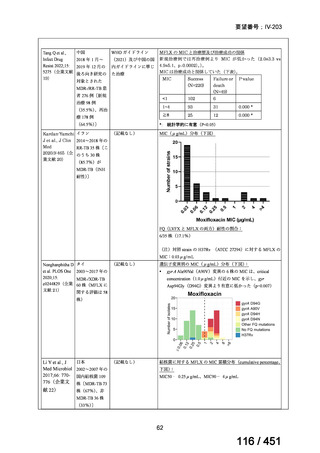
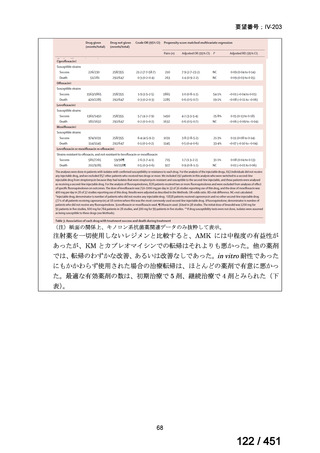
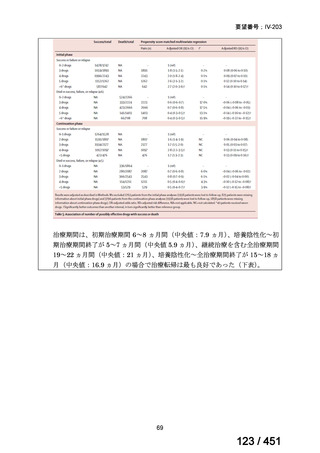
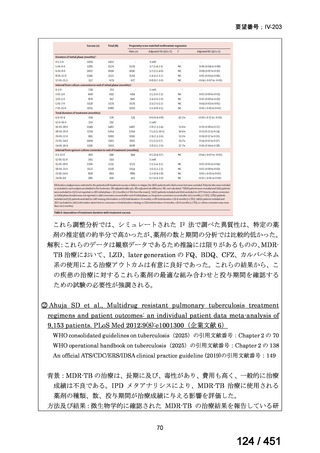
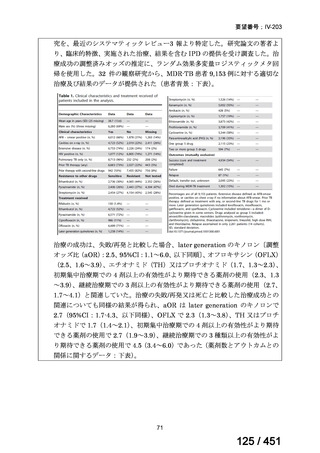
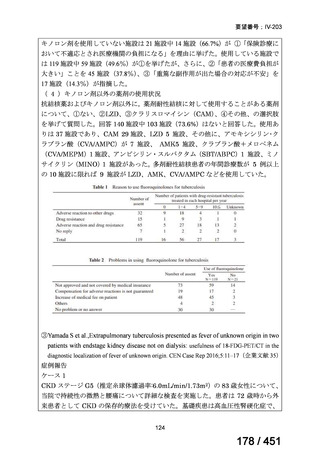
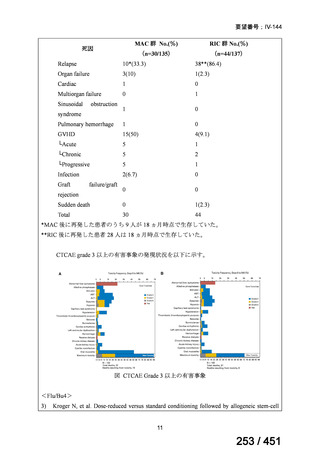
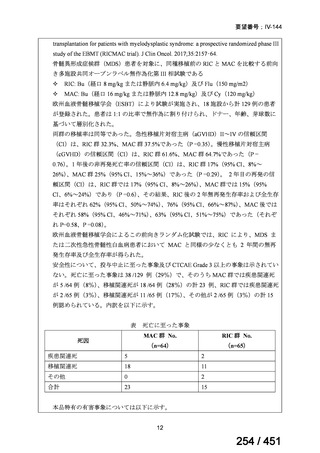
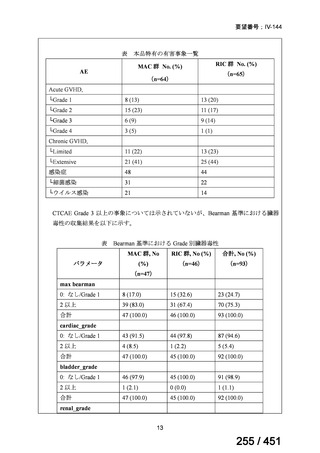
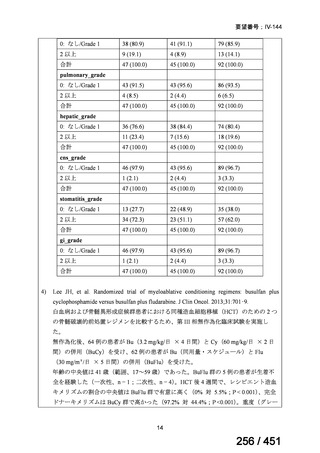
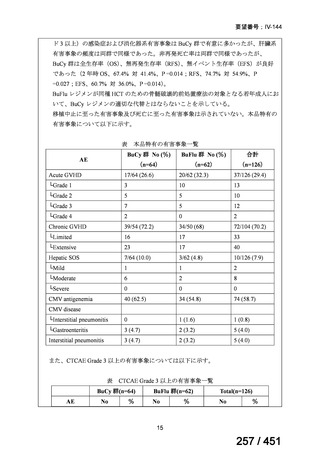
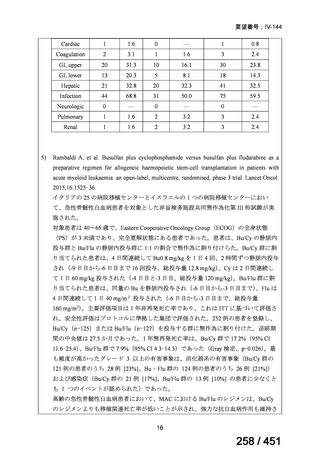
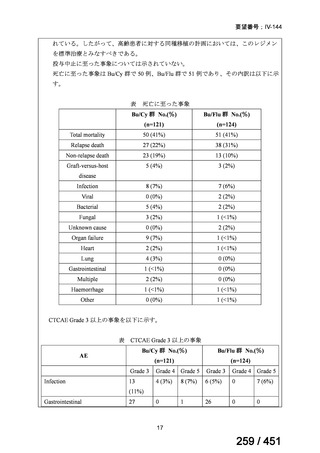
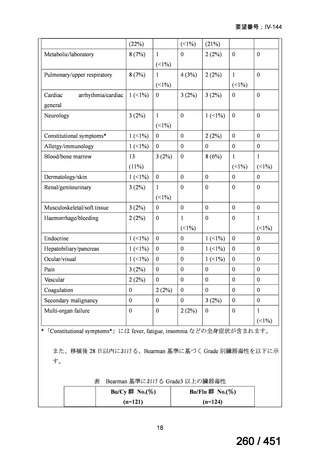
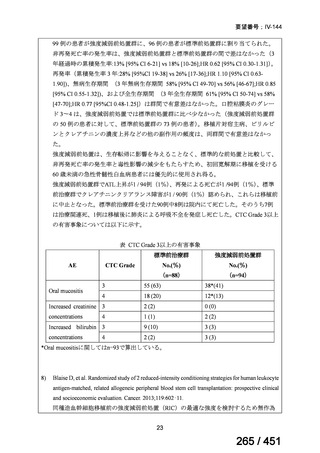
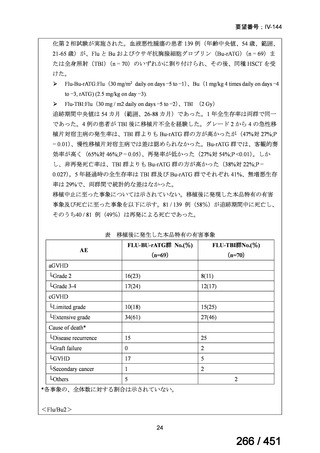
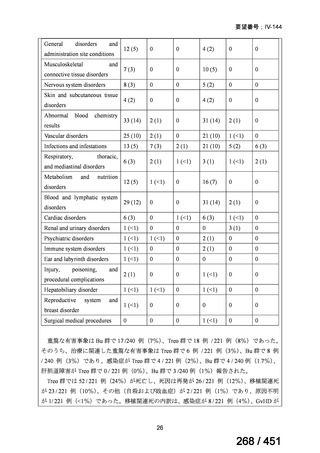
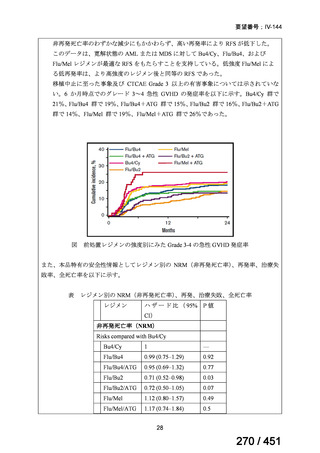
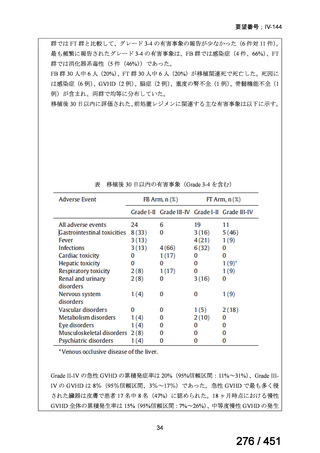
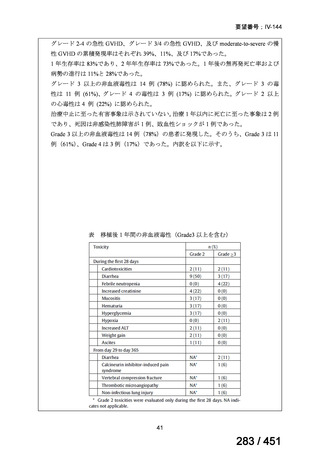
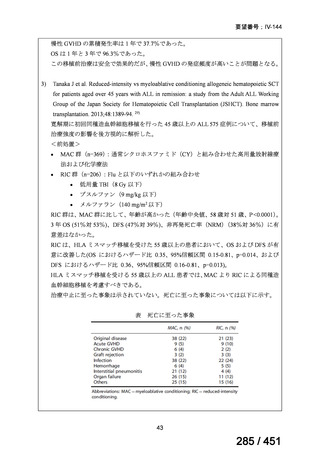
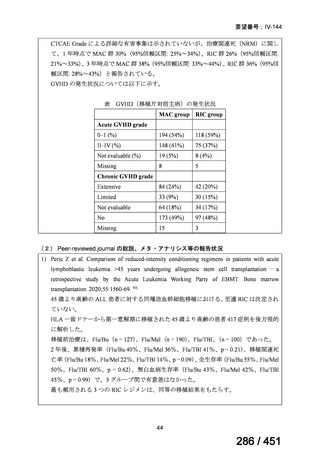
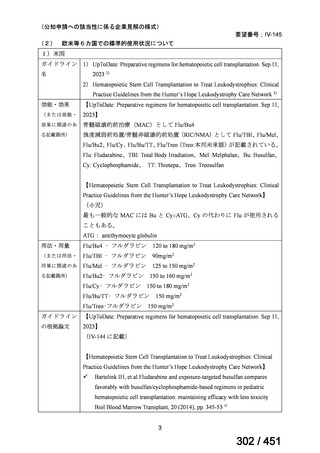
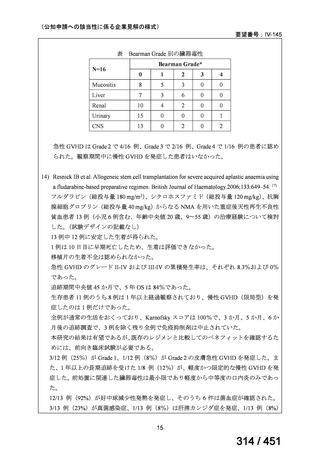
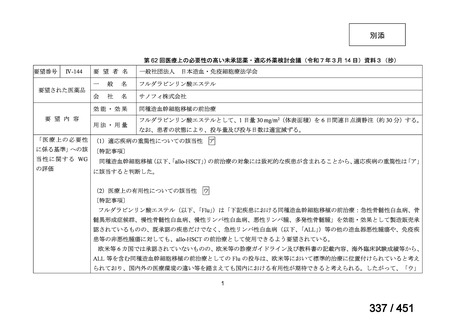
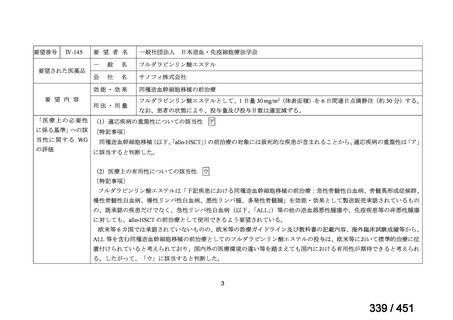
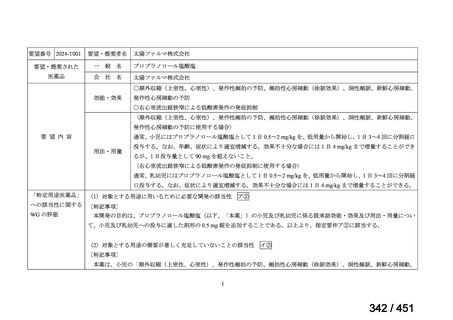
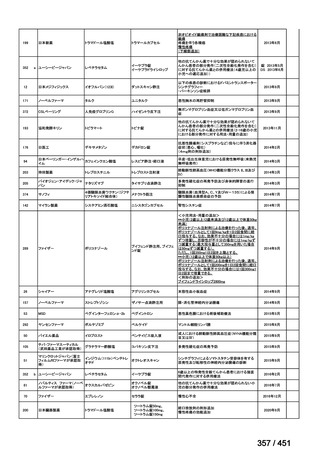
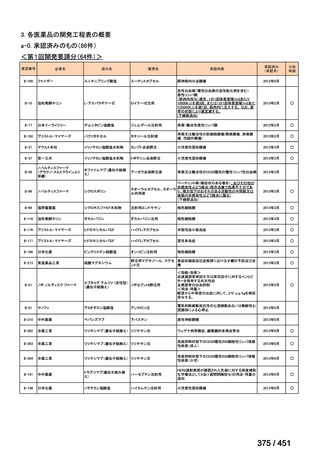
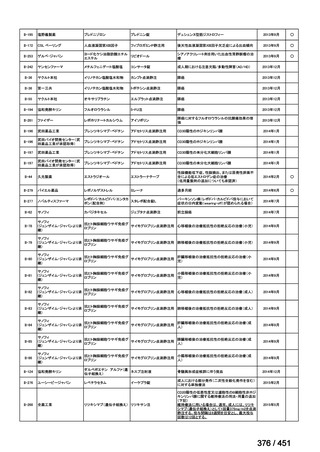
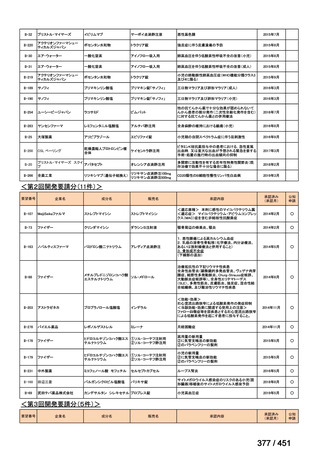
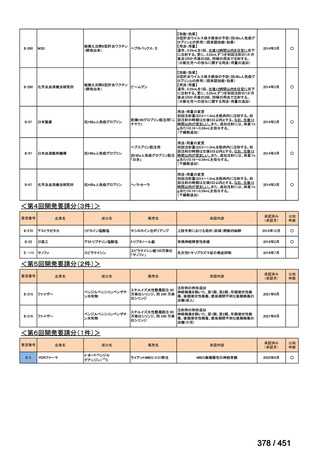
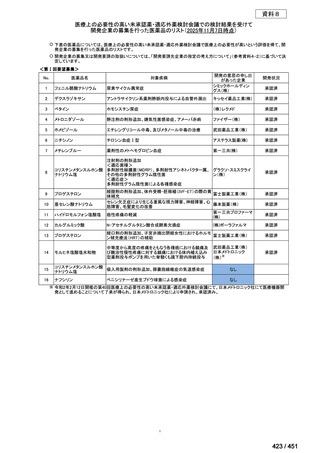
両薬剤とも概ね忍容性は良好であり、死亡に至った有害事象はなく、投与中止に至
った有害事象は 4/74 例に認められた〔いずれも非重篤、丘疹性皮疹(軽度、Grade
1、治験責任医師の評価は Pa400M と関連)、心室性期外収縮(軽度、治験責任医
師の評価はプラセボと関連)、洞性頻脈(中等度、Grade 2、治験責任医師の評価は
Pa400M と関連しない)、及び 12 誘導心電図の QTcF 延長(軽度、治験責任医師
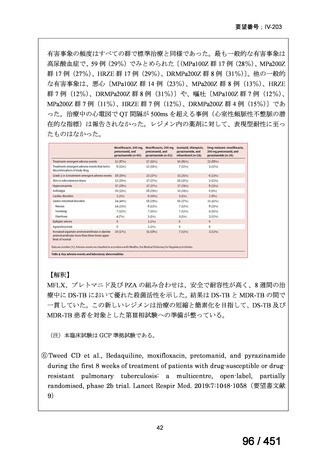
の評価はプラセボと関連しない)。治験薬投与下の有害事象(TEAE、2 例以上)の
発現割合に関して、嘔気、頭痛及びめまいを除いて、試験群間で意味のある差は認
められなかった(下表)。
59
113 / 451