令和8年度厚生労働省予算概算要求の主要事項 (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/yosan/yosan/26syokan/ |
| 出典情報 | 令和8年度厚生労働省予算概算要求の主要事項(8/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
GMP管理体制強化等事業
令和8年度概算要求額
1.2億円(1.2億円)※()内は前年度当初予算額
1 事業の目的
令和2年度に、後発医薬品メーカーにおいて、製造工程中における薬物混入などの重大な違反行為が発覚。健康被害の発生のほか、製
品回収や業務停止処分による出荷停止が行われるなど、医療現場に大きな混乱が発生し、医薬品の品質に対する信頼回復が急務となっ
た。現時点においても、依然として行政処分事例が発生している。
当該事案では、製造記録の二重帳簿の作成や品質試験結果のねつ造など、発見が困難な法令違反が行われており、現在の行政におけ
るGMP(医薬品の製造管理及び品質管理に関する基準)の査察体制では十分対応できていない実態が明らかになっている。
第三者委員会等による調査の結果、原因の一つとして、企業における製造管理及び品質管理に対する意識の低下が指摘されている。
国と都道府県の薬事監視の情報共有を含めた連携体制が必ずしも十分に整備されているとは言いがたいことも指摘されている。
→
医薬品医療機器総合機構(PMDA)及び都道府県の調査員の調査能力向上及び均てん化を進め、巧妙な法令違反行為を発見できるよう
にするとともに、医薬品メーカーにおける製品品質確保やGMP適合性遵守に関するコンプライアンスを向上させることを目的とする。
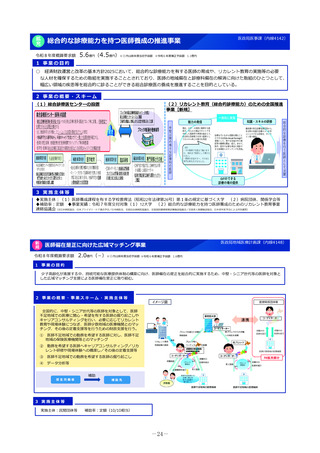
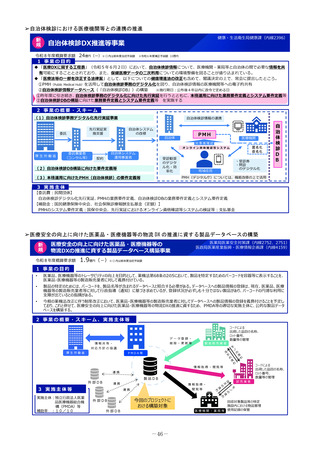
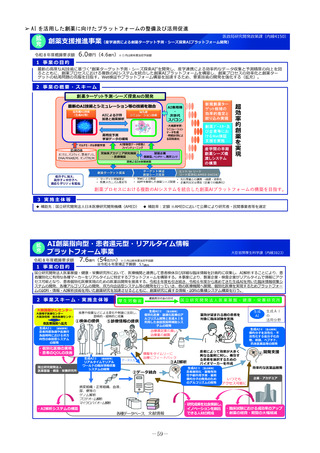
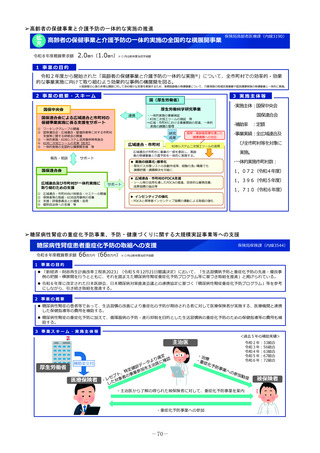
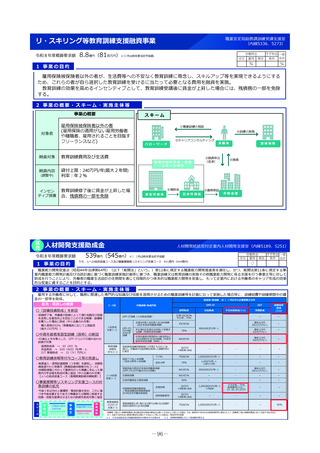
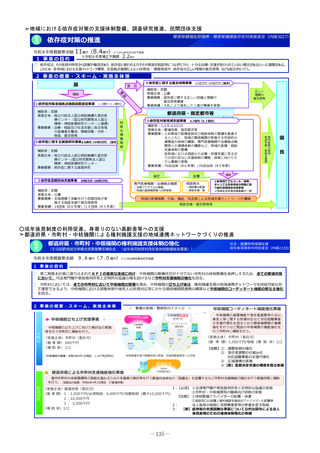
2 事業の概要・スキーム
国内のGMP査察能力を向上させるため、調査員の教育訓練や都道府県による査察への同行等による知識共有、製造管理等に係る最新技術
の情報収集、海外規制当局との情報交換などを行うとともに、PMDAの調査員及び外部専門人材の確保を行う。
製造業者の役員、従業員に加え、製造業者を管理監督する製造販売業者や都道府県職員等、 GMPに関する全ての関係者を対象とした講
習会を開催増やし、医薬品メーカーにおける品質確保等に係るコンプライアンス意識や品質文化(クオリティ・カルチャー)の更なる醸
成等を図る。(令和4年度~)。
国と都道府県の薬事監視について、速やかな情報共有も含めた連携体制を整備し、その質的な向上を図るため、全国のGMP調査における
不備事項を収集・分析等する体制を構築。都道府県の調査水準の向上及び均てん化を図るとともに、業界に実践的な啓発活動を行う(令
調査員、外部専門人材の確保
和6年度~)。
情報交換
3
4
実施主体等
PMDA、補助率:10/10
事業実績
厚生労働省
補助
PMDAによる都道府県GMP調査体制への支援(令和6年度)
・都道府県GMP調査への同行:3件
・都道府県GMP調査員への研修機会の提供:延べ180人 等
バイオ後続品品質・臨床的同等性情報提供等推進事業
令和8年度概算要求額
教育訓練・調査
の均てん化等
海外規制当局
都道府県等
情報の共有
PMDA
法令遵守の啓発
製薬業界
医薬局医薬品審査管理課
(内線2746)
42百万円( - )※()内は前年度当初予算額
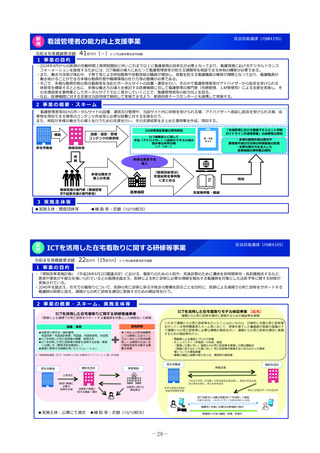
1 事業の目的
○ 先行するバイオ医薬品と同等/同質であり、安価なバイオ後続品(バイオシミラー)について、医療保険制度の持
続可能性を維持する上で更なる使用促進が不可欠。バイオ後続品の特性や使用状況等を考慮しつつ、バイオ後続品が
使用されやすい環境を整備する必要がある。
○ 医療機関におけるバイオ後続品の使用に関する考え方として、品質や有効性、安全性に疑問がないバイオ後続品は
積極的に使用するとの声が多く、普及啓発の観点からは、これらの情報を整理し、対外的に発信していくことが重要
である。また、こうした情報は、医療現場におけるバイオ後続品活用のために必要であり、迅速に取り組む必要があ
ると指摘されている。
○ このため、①品質の観点から同等性に関する客観的な評価を実施するとともに、②医療情報DBを活用して切替時
の有効性及び安全性に関するデータを取得し、③ワンストップで情報を公表し普及啓発を図ることにより、品質、有
効性及び安全性が確保されたバイオ後続品の活用推進につなげる。
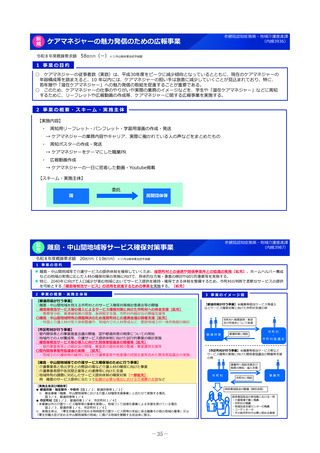
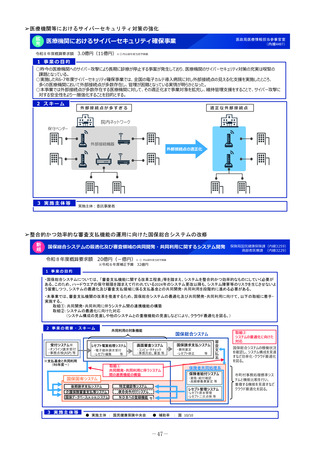
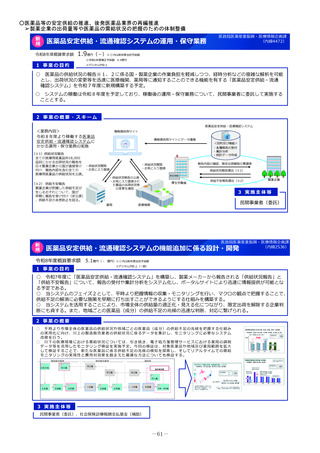
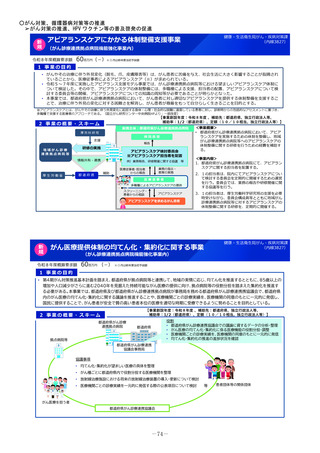
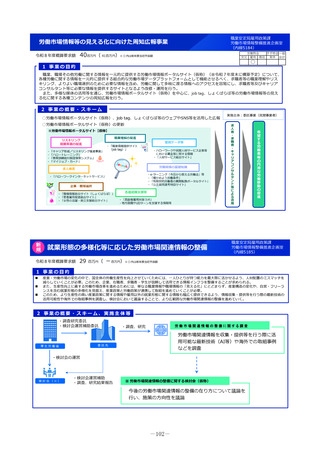
2 事業の概要・スキーム
製薬企業
医療情報
DB
3 実施主体等
<国立医薬品食品衛生研究所>
①品質の同等性に関する評価
②使用実態下での切替えに関する有用性の情報
品質データのほか
切替え時等の有用性
ジェネリック医薬品・
バイオシミラー品質情報検討会
評価結果の積極的な公表・周知
品質、有効性及び安全性が確保された
バイオシミラーの活用推進
-67-
実施主体:国立医薬品食品衛生研究所
費用内訳:
・品質試験検査費
・使用実態下での臨床的同等性評価
・会議費