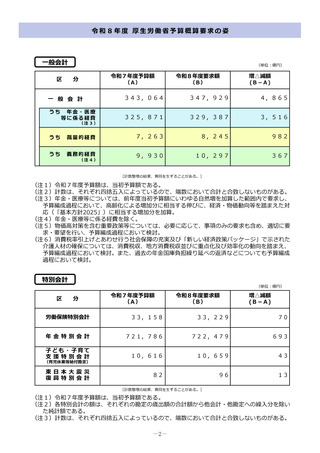
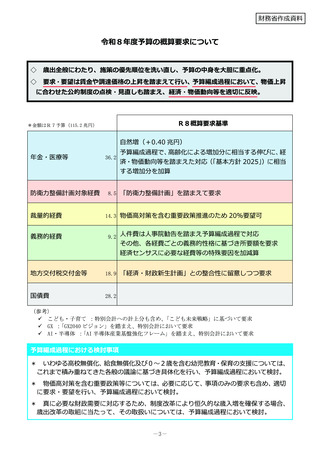
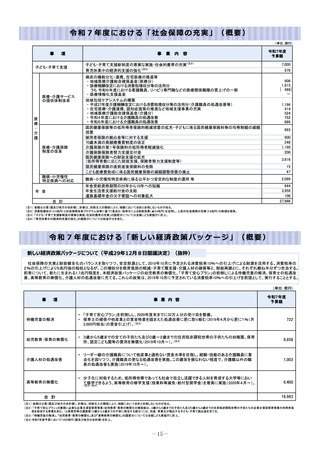
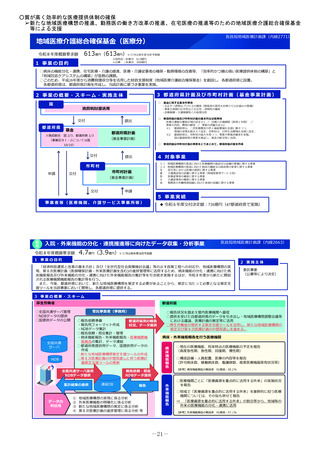
令和8年度厚生労働省予算概算要求の主要事項 (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/yosan/yosan/26syokan/ |
| 出典情報 | 令和8年度厚生労働省予算概算要求の主要事項(8/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和8年度概算要求額
88百万円(-) ※()内は前年度当初予算額
医政局研究開発政策課
(内線4165)
※令和6年度補正予算額 7.9億円
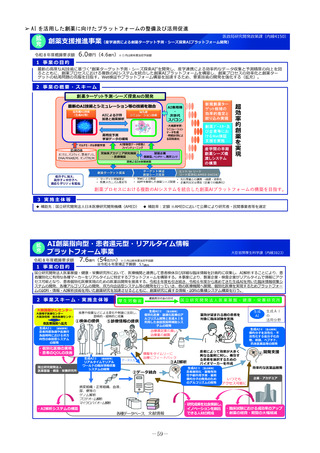
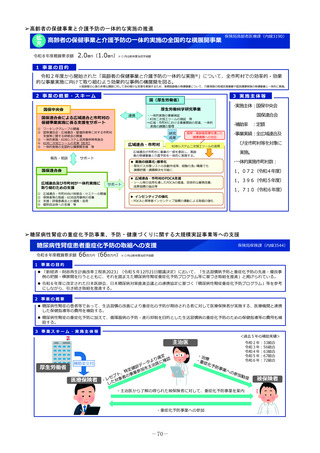
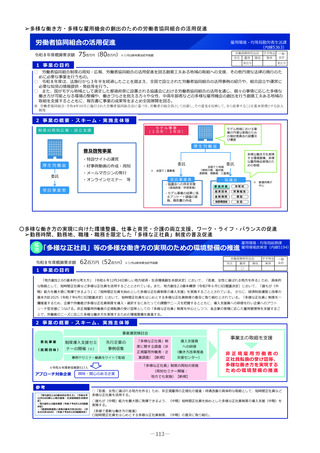
1 事業の目的
• 日本の創薬力向上のためには、国際レベルの治験・臨床試験が実施できる体制強化を行う必要があり、創薬シーズ
から第1相臨床試験に入る段階であるヒト初回投与(FIH:First In Human)試験の重点支援が重要である。
• 新たに、革新的なモダリティに対応可能な国際的に競争力のあるFIH試験実施体制の国内整備を進めることで、海外
発シーズも含む革新的新薬候補の国内での研究開発を促進する。
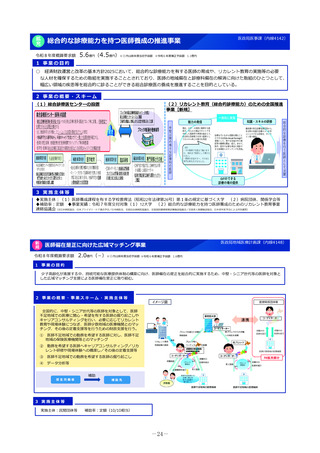
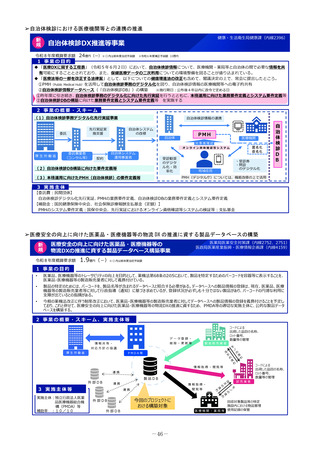
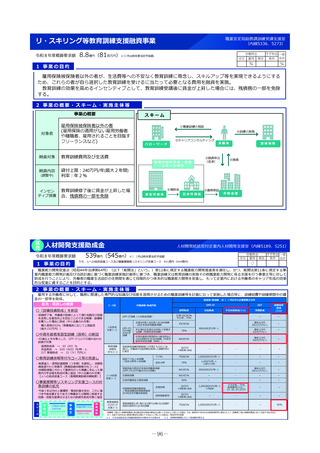
2 事業の概要
1. 国立がん研究センター中央病院が実施主体となり、新たに、革新的なモダリティに対応可能な国際的に競争力の
ある①FIH試験体制、②GMP準拠治験薬製造機能、③研究施設を併設した創薬拠点の整備に向けた仕様設計を行
い、国内のFIH試験の中核的な役割を担う体制の整備を進める。
2. 国立健康危機管理研究機構及び国立成育医療研究センターにおけるFIH試験体制を引き続き整備するとともに、そ
の体制を活用し、革新的なモダリティのFIH試験について、対応可能な人材の育成、試験実施の相談・支援を行う
ための体制整備を行う。
国立がん研究センター等
厚
海外発シーズの日本導入
補助
生
労
働
省
研究施設
GMP準拠製造施設
FIH試験施設
基礎研究
治験薬製造
ヒトへの投与
重点支援
後期臨床試験
低分子化合物
早期臨床試験
治療標的同定
基礎研究
新規モダリティ
医
療
実
装
日本の創薬力の強化
3 実施主体等
◆補助先:
1.国立がん研究センター
2.国立健康危機管理研究機構、国立成育医療研究セ
ンター
◆補助率:10/10
◆対象経費:
1.革新的なモダリティに対応可能な国際的に競争力
のあるFIH試験体制・GMP準拠治験薬製造機能・研
究施設を併設した創薬拠点の仕様設計に係る費用
2.FIH試験体制の整備に係る費用、革新的なモダリ
ティのFIH試験を実施できる人材の育成、試験実施
の相談・支援を行うための体制整備に係る費用
➢小児・希少疾病用医薬品等におけるドラッグロス解消に向けた取組の強化
PMDA小児・希少疾病用医薬品等薬事相談センター事業
令和8年度概算要求額
医薬局
医薬品審査管理課
(内線2746)
1.2 億円(1.2億円)※()内は前年度当初予算額
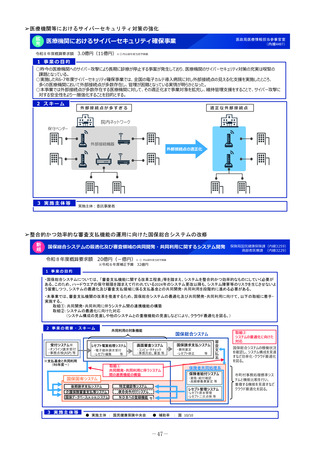
1 事業の目的
○ 近年、希少疾病用・小児用等の医薬品を中心に、欧米では承認されてい
る医薬品が日本で開発されない、ドラッグ・ロスの拡大が指摘されている。
○ 我が国にとって医療上必要な医薬品の導入を促進するため、厚労省の検
討会(※)において薬事規制の大幅な見直しを進めるとともに、その実行
のため、令和6年度より「PMDA小児・希少疾病用医薬品等薬事相談セン
ター」を設置し、以下の対応を進めている。
① 希少疾病用医薬品指定の早期化・拡大
② 小児用薬の開発計画の策定を企業に促しPMDAが確認する仕組みの対応の促進
③ 「医療上の必要性の高い未承認薬・適応外薬検討会議」における評価の加速化
④ PMDA相談手数料の企業等への補助
(※)創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(令和6年4月報告書とりまとめ)
○ 令和8年度は、①見直しに伴う希少疾病用医薬品の指定増加等に対応するための審査体制の確保を行うとともに、
②未承認薬等検討会議において学会等の要望を待たずに国が主導的に評価・開発要請を行うスキームに迅速に対応する。
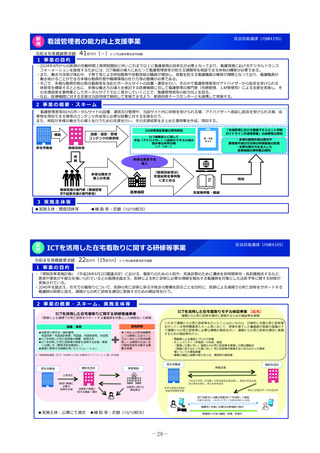
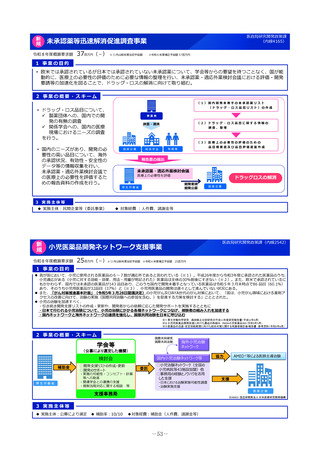
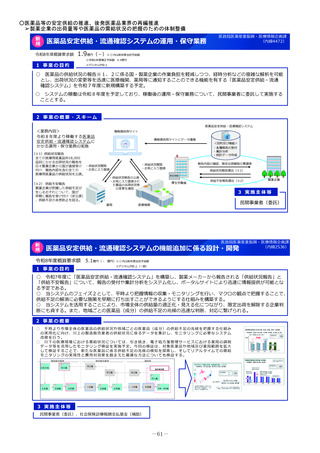
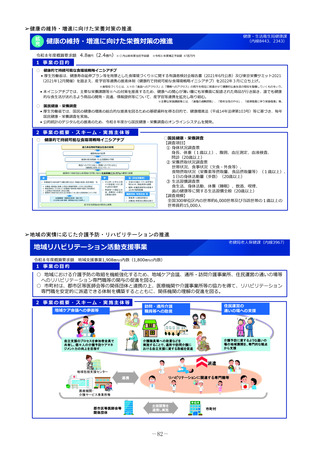
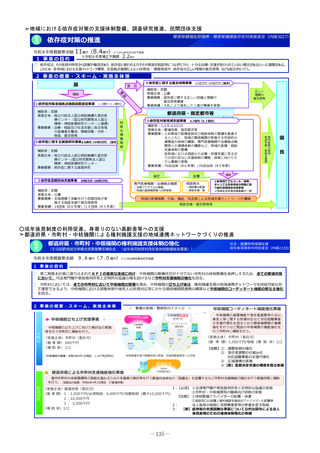
2 事業の概要・スキーム
3 実施主体等
実施主体:PMDA
小児・希少疾病用医薬品等薬事相談センター
①希少疾病用医薬品
指定・指定見直し
の相談・審査
②小児用医薬品
開発計画の確認・
進捗管理
③未承認薬検討会議
評価の加速 (調査、
評価書作成等)
PMDA相談手数料の補助
対象:上記①・②に関して企業が支払う相談手数料。未承認薬等検討会
議での開発公募品や医師主導治験による開発品。
-52-
費用内訳:
・相談手数料の補助(企業、アカデミア
等)
・体制確保の人件費:補助率50/100等