令和8年度厚生労働省予算概算要求の主要事項 (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/yosan/yosan/26syokan/ |
| 出典情報 | 令和8年度厚生労働省予算概算要求の主要事項(8/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
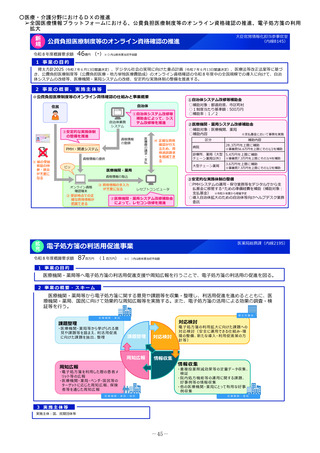
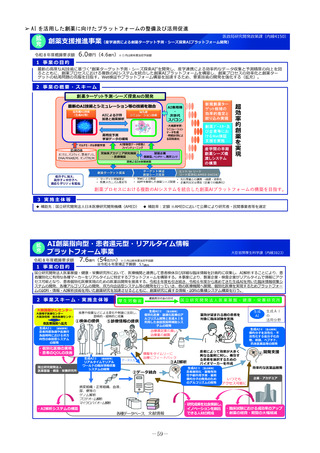
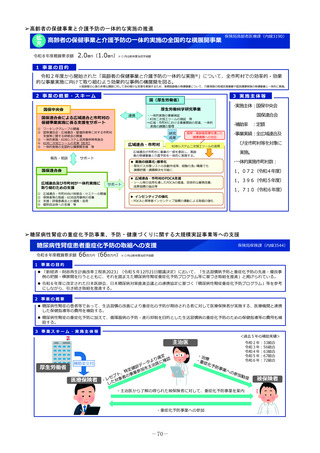
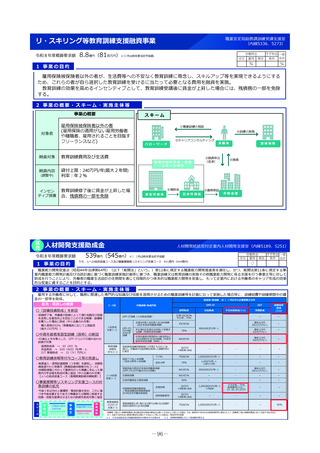
小児医薬品開発支援体制強化事業
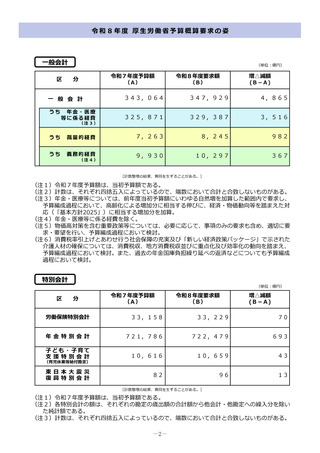
令和8年度概算要求額
1 事業の目的
43百万円(30百万円)※()内は前年度当初予算額
小児用医薬品のドラッグ・ラグ/ドラッグ・ロスが深刻化する中で、「経済財政運営と改革の基本方針 2023(令和5年6月16日閣議決定)」や「創薬力の向
上により国民に最新の医薬品を迅速に届けるための構想会議 中間とりまとめ(令和6年5月22日)」等において、小児用医薬品開発の促進が指摘されている。
小児領域の医薬品開発を促進するため、国立成育医療研究センターにおける小児用医薬品開発の支援体制を強化し、小児用医薬品開発のサポート(製薬
企業、アカデミア等への開発サポート等)を強化する。
さらに、日本における産官学患の4者が参画する小児医薬品開発推進コンソーシアムの本格始動に伴い事務局機能を拡大し、より良い小児医薬品等の開発
環境を整備するとともに、小児治験に関する人材育成・研修業務を強化する。
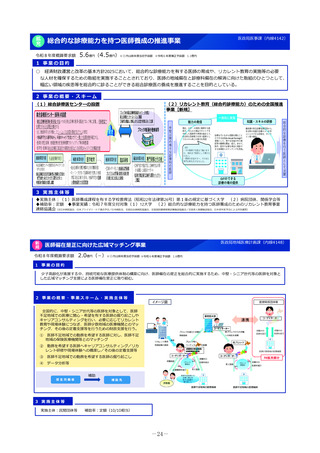
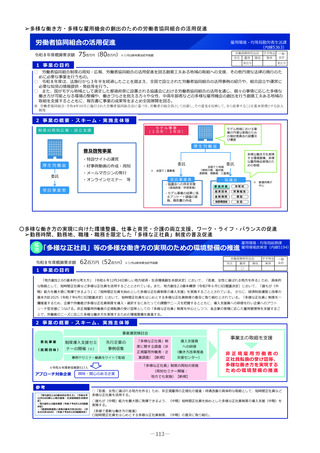
2 事業の概要・スキーム
厚生労働省
国立研究開発法人 国立成育医療研究センター
(i)小児医薬品開発支援の体制強化
・アカデミア等からの出向者の受け入れ、SMO/CROへの業務委託
(ii)小児医薬品開発支援内容の充実
・新たにアカデミア主導での小児医薬品開発を支援
・開発のサポート(実施の可能性・コンセプト・計画等への助言、関連学会との連携の支援、規制当局対応に関する相談等)
・国内における使用実態等公知申請に必要となる情報収集の支援(小児医療情報収集システム(DB)活用による情報収集を含む)
・開発企業がいない小児用医薬品の開発に関して、必要に応じて治験を支援(※)し、企業導出を支援(プロトコル作成助言等)
※国立研開発法人 日本医療研究開発機構(AMED)臨床研究・治験推進研究事業
(iii)小児治験ネットワークとの連携・体制強化
・小児治験ネットワーク体制の強化、産学官患からなる小児医薬品開発推進のコンソーシアムの本格始動に伴う事務局機能の拡大
・国内小児治験について、小児治験ネットワーク等につなぎ、被験者の組入れを加速化
(iv)小児治験に関する普及啓発・研修の実施
・保護者、患者会:DCTを含む小児治験の普及啓発による患者参画の推進(関係学会と連携)
・医療従事者:小児用医薬品治験に関する理解、DCT治験に関する知識を広めるための講習会を開催
・製薬企業:小児治験ネットワーク及び本支援スキームの普及啓発の強化
・関係学会:治験登録促進の呼びかけ、DCTの理解・普及啓発
等
◆ 実施主体:国立研究開発法人 国立成育医療研究センター◆ 補助率:定額 ◆対象経費:補助金(人件費等)
3 実施主体等
医政局研究開発政策課(内線2542)
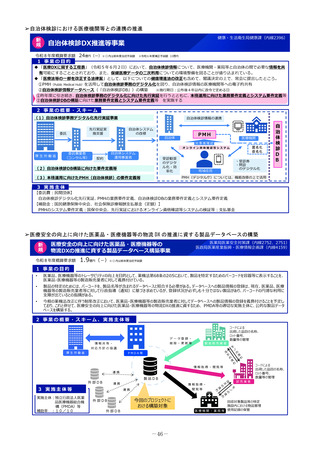
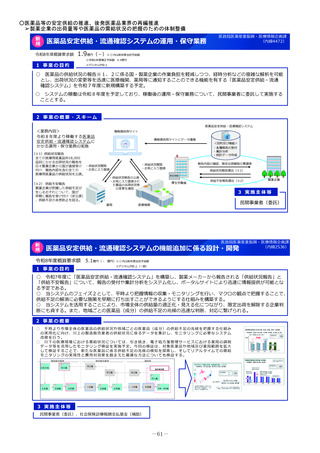
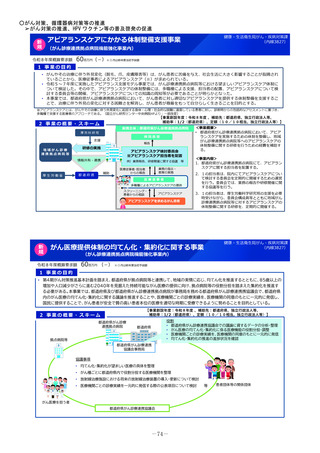
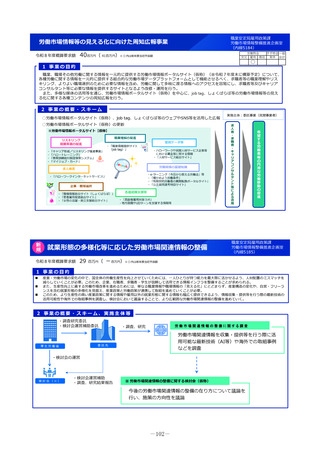
未承認薬等アクセス確保事業
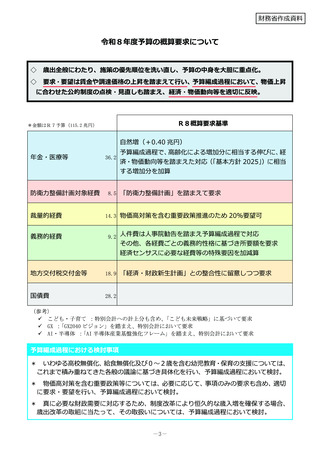
令和8年度概算要求額
1 事業の目的
49百万円(-)※()内は前年度当初予算額
我が国において、欧米で承認されているにもかかわらず、国内では未承認の医薬品が143 品目あり、このうち国内で開発未着手となっている医薬品は令和5
年3月末時点で86 品目(60.1%)あり、そのうち希少疾病用医薬品が40品目(47%)と、ドラッグ・ロスが生じている(※1)。
希少疾病用医薬品や感染症危機対応医薬品等は、患者数が少ないため企業が開発を見送る場合が多く、国の強力な関与が必要となっている(※2)。
ドラッグロス解消に向けた取組として、医療上の必要性の高い未承認薬・適応外検討会議を通じて開発要請等の加速化を図るものの、超希少疾病用医薬品*
や感染症危機対応医薬品等に関しては、市場規模が極めて小さく、治験実施が極めて困難である。超希少疾病の中でも、患者数が1名から数十人規模の特に
薬事承認取得が困難な疾病もあり、それら疾患の患者に対する国内未承認薬剤へのアクセス確保は重要な課題である。
再生・細胞医療、遺伝子治療等の領域においても、医療上のニーズはあるが市場規模が小さく治験の実施が困難な疾患等について、有効性・安全性を確認し、
アンメットメディカルニーズに対する再生医療等技術を国民に迅速かつ円滑に届けることは重要な課題である。
そこで 超希少疾病の中でも特に国内患者数が少ない疾病や平時には発生のない感染症等の患者を対象に、保険外併用療養費制度を利用した特定臨床研究・
医師主導治験等の実施を支援することで、国内未承認の医薬品・再生医療等製品及び国内で開発される再生医療等技術へのアクセスを確保するとともに、当
該薬剤等の有効性・安全性に関する知見の収集を進める。
本事業が対象とする未承認薬等及び再生医療等技術は、欧米で承認されている医薬品・再生医療等製品で、国内に開発権を有する企業がなく、また市場性等
の観点からも企業による国内開発が見込まれない、年間売上高が概ね5億円未満と推定される品目及び、国内で研究開発が進められているが市場規模が小さ
く治験の実施が困難な疾病に対する再生医療等技術とする。
※1 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会 報告書 参考資料(令和5年6月)
※2 創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議 中間とりまとめ(令和5年5月)
*超希少疾病:国内患者数1,000人程度未満のもの
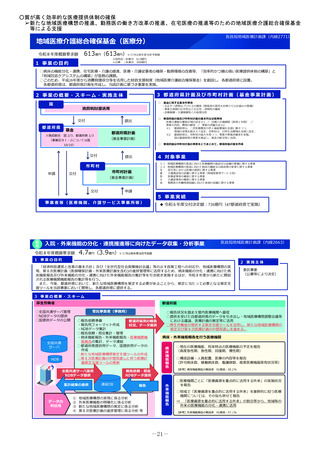
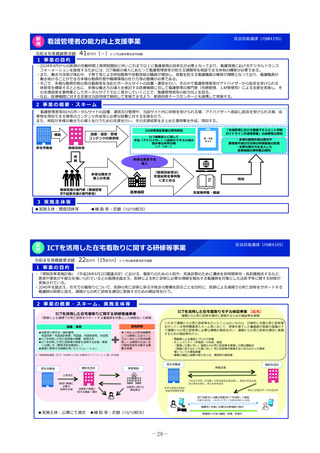
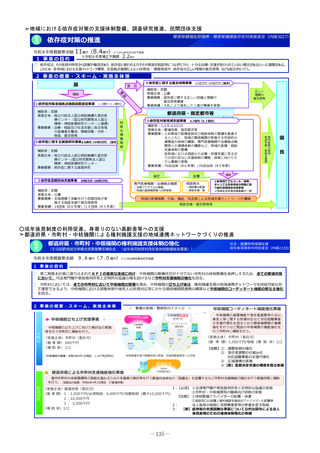
2 事業の概要・スキーム
【対象疾患及び薬剤等に関する要件(案)】
・予後不良又はQOLが著しく低い疾患、国内で受診可能な他の
治療法がない又は他の治療法では効果が不十分な疾患等
・国内推定患者数が20名程度未満の疾患に対する薬剤等(平時に
は国内で発生のない健康危機管理上重要な疾患を含む)、もし
くは対象患者数が年間20名程度未満の国内開発の再生医療等技術
・年間売上高が概ね5億円未満と推定される薬剤等
・単回もしくは複数回の投与で治療が終了する薬剤等
※上記の要件は、R8年度本事業において領域毎に最適化を図る
初年度(R8)
:制度設計(対象疾患・対象薬剤等、
評価方法、プロトコールの検討等)
2年目以降(R9~)
:未承認薬等の臨床試験開始
補助金
厚生労働省
国立がん研究センター
国立精神・神経医療研究センター
国立成育医療研究センター
国立健康危機管理研究機構
超希少疾病領域
•
•
研究者/主治医
国立高度専門医療研究センター等を
代表機関とし、臨床研究中核病院等
を協力機関とする
3 実施主体等
国内未承認の医薬品・
再生医療等製品
国内開発の再生医療等
技術
・保険外併用療養費制度を利用
◆ 実施主体:国立がん研究センター、国立精神・神経医療研究センター 、国立成育医療研究センター 、国立健康危機管理研究機構
◆ 対象経費 :補助金 ◆補助率:定額
-54-
未承認薬等による
治療機会を確保
診療データ
研究データ
の利活用
企業より開発
申出があった
場合
患者
製薬企業
薬事申請へ利活用
可能なデータを
企業へ導出