令和8年度厚生労働省予算概算要求の主要事項 (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/wp/yosan/yosan/26syokan/ |
| 出典情報 | 令和8年度厚生労働省予算概算要求の主要事項(8/26)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(内線4165)
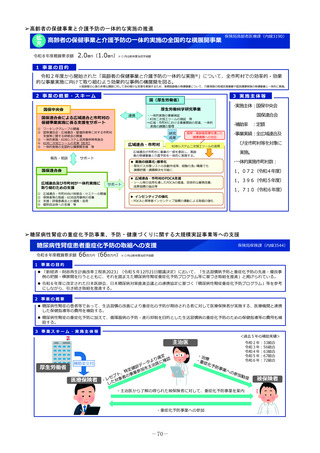
未承認薬等迅速解消促進調査事業
令和8年度概算要求額
37百万円(-) ※()内は前年度当初予算額
※令和6年度補正予算額 57百万円
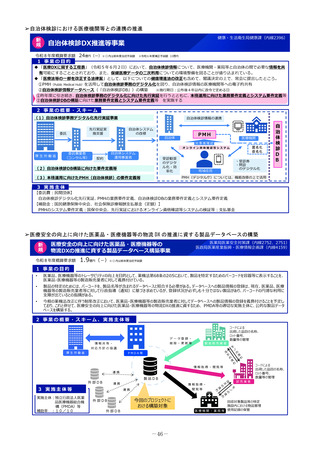
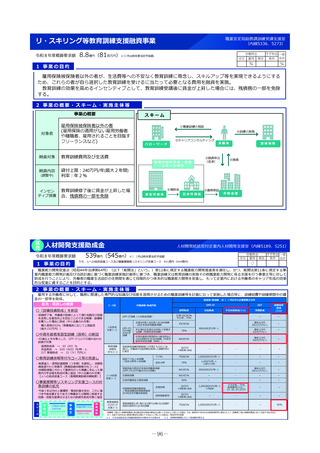
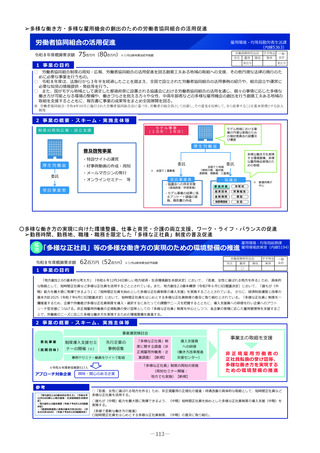
1 事業の目的
• 欧米では承認されているが日本では承認されていない未承認薬について、学会等からの要望を待つことなく、国が能
動的に、医療上の必要性の評価のために必要な情報の整理を行い、未承認薬・適応外薬検討会議における評価・開発
要請等の加速化を図ることで、ドラッグ・ロスの解消に向けて取り組む。
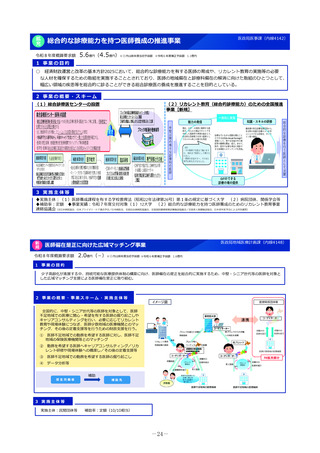
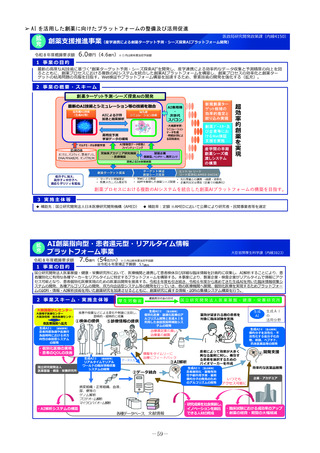
2 事業の概要・スキーム
(1)国内開発未着手の未承認薬リスト
(ドラッグ・ロス品目リスト)の作成
• ドラッグ・ロス品目について、
製薬団体への、国内での開
発の有無の調査
関係学会への、国内の医療
現場におけるニーズの調査
を行う。
事業者
(2)ドラッグ・ロス品目に関する情報の
調査・連携
調査、整理
(3)医療上の必要性の評価のための
• 国内のニーズがあり、開発の必
要性の高い品目について、海外
の承認状況、有効性・安全性の
データ等の情報収集を行い、
未承認薬・適応外薬検討会議で
の医療上の必要性を評価するた
めの報告資料の作成を行う。
製薬企業
品目概要書及び品目評価書案作成
有識者
関係学会
報告書の提出
未承認薬・適応外薬検討会議
医療上の必要性を評価
開発要請
開発公募
厚生労働省
ドラッグロスの解消
製薬企業
3 実施主体等
◆ 実施主体:民間企業等(委託事業)
◆ 対象経費 :人件費、諸謝金等
医政局研究開発政策課(内線2542)
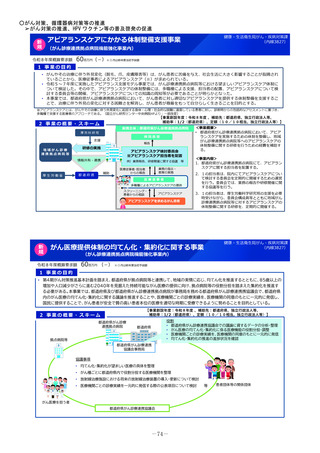
小児医薬品開発ネットワーク支援事業
令和8年度概算要求額
25百万円(-)※()内は前年度当初予算額 ※令和6年度補正予算額 25百万円
1 事業の目的
我が国において、小児に使用される医薬品の6~7割が適応外であると言われている(※1)。平成26年度から令和3年度に承認された医薬品のうち、
小児適応がある(小児に対する効能・効果、用法・用量が明記された)医薬品は全体の30%前後にすぎない(※2)。また、欧米で承認されているに
もかかわらず、国内では未承認の医薬品が143 品目あり、このうち国内で開発未着手となっている医薬品は令和5年3月末時点で86 品目(60.1%)
あり、そのうち小児用医薬品が32品目(37%)と(※3)、小児用医薬品の開発は遅々として進んでいない状況にある。
また、「がん対策推進基本計画」(令和5年3月28日閣議決定)の小児がん及びAYA世代のがん対策において、「国は、小児がん領域における薬剤ア
クセスの改善に向けて、治験の実施(国際共同治験への参加を含む。)を促進する方策を検討する」こととされた。
小児の治験を加速すべく、
・引き続き開発支援リストの作成・更新や、開発者からの依頼に応じた開発サポートを実施するとともに
・日本で行われる小児治験について、小児の治験にかかる各種ネットワークにつなげ、被験者の組み入れを加速する
・国内ネットワークと海外ネットワークの連携を強化し、国際共同治験を日本に呼び込む
※1 厚生労働科学研究 森田修之分担研究の平成11年度研究報告書(平成12年4月)
※2 小児用医薬品開発促進に向けた最近の取組み PMDA小児医薬品WG(令和5年3月)
※3 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会 報告書 参考資料(令和5年6月)
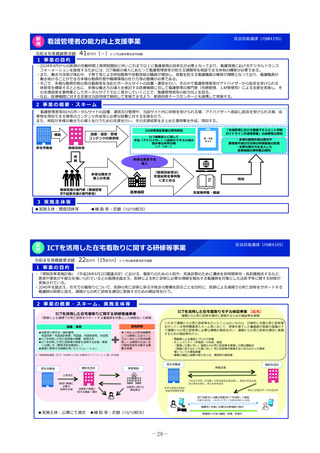
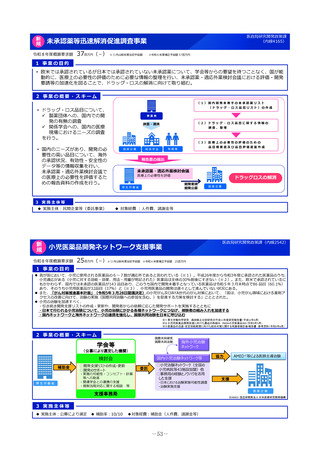
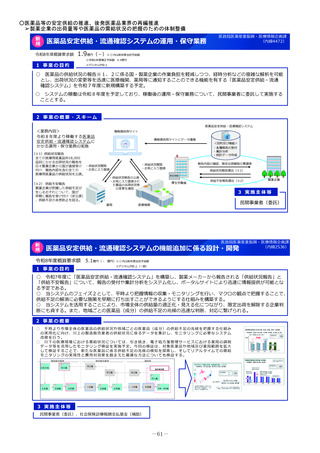
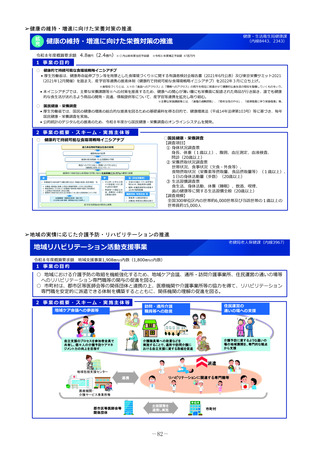
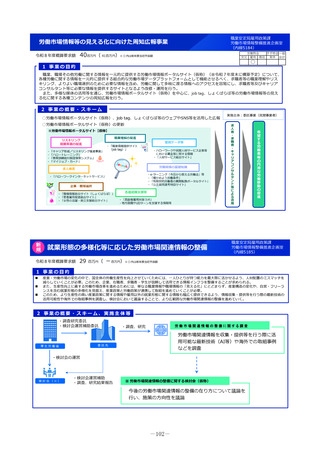
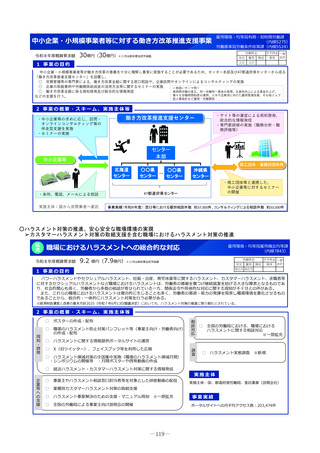
2 事業の概要・スキーム
国際共同研究
国際共同治験
学会等
(公募により選定した機関)
検討会
補助金
厚生労働省
○開発支援リストの作成・更新
○開発のサポート
海外小児治験
ネットワーク
国内小児治験ネットワーク等
委託
・実施の可能性・コンセプト・計画
等への助言
・関連学会との連携の支援
・規制当局対応に関する相談 等
○小児治験ネットワーク(全国の
小児病院等43施設加盟)他
○事務局の経験とノウハウを活用
した支援
・日本における治験実施可能性調査
・治験実施支援
支援事務局
支援
製薬企業
※AMED:国立研開発法人 日本医療研究開発機構
3 実施主体等
◆ 実施主体:公募により選定 ◆ 補助率:10/10
AMED※等による医師主導治験
協力
◆対象経費:補助金(人件費、諸謝金等)
-53-