『規制改革実施計画』 (77 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/publication/p_plan.html |
| 出典情報 | 規制改革実施計画(6/13)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
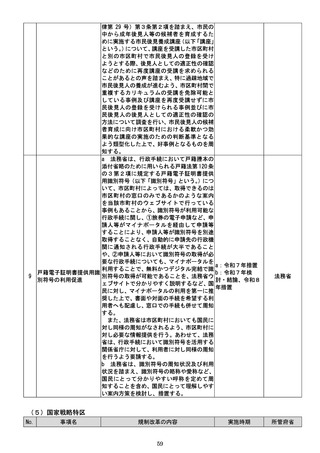
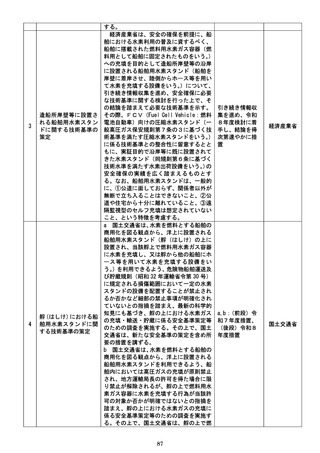
あっても、公の秩序、善良の風俗又は公衆
の衛生を害するおそれがない限り、特許を
受けることを可能とすることについて検
討する必要があること。
・利用申請から利用者が実際にデータの利用
を開始し得るまでに要する期間について、
研究者、企業等のニーズを踏まえた上で、
公的DBにおけるデータ利用申請からデ
ータ利用開始までに要する期間も踏まえ
つつ、可能な限り短期間での提供が可能と
なるよう検討する必要があること。
・一つの研究等に対する個別限定的な契約だ
けではなく、同一目的(例えば、ある領域
の治療薬開発)上の複数の研究(その実施
時期が異なるもの)に利用することが同一
契約で実施できる包括的な利用契約形態
の導入を検討する必要があること。
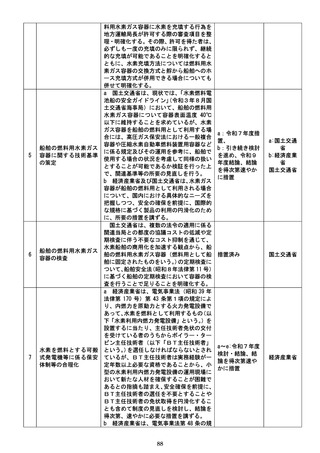
・提供申出(変更申出を含む。以下同じ。)に
係る手数料(基本利用料(審議や実地監査
等に係る費用)
、調整業務料(提供するデー
タの内容の調整事務に係る費用)、データ
料(データベースの運用及びデータ抽出に
係る費用)及びクラウド環境利用料(クラ
ウド環境の構築及び提供に係る費用))に
ついては、提供申出ごとに積算される実費
制のほか、事前に手数料の概算を把握でき
る制度(一定期間ごとに定額で積算される
定額制等)の導入を検討する必要があるこ
と。
・審査委員会による審査の結果は定期的に公
表するなど、審査の透明性を確保する必要
があること。
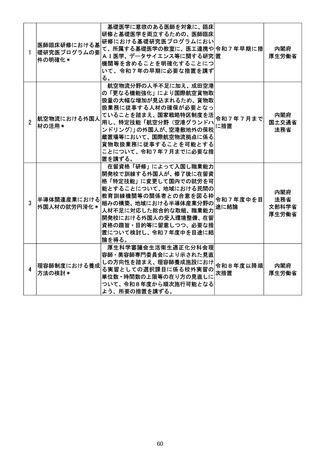
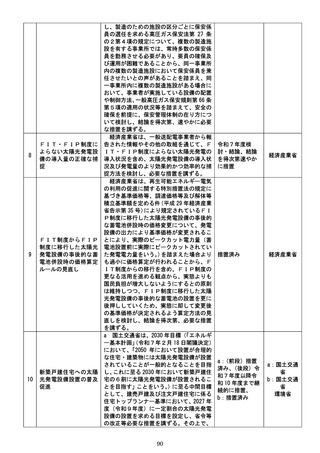
承認前の医薬品等に係る広告については、
医薬品等の不適正な使用とそれによる危害
の発生を防止するため、医薬品、医療機器等
の品質、有効性及び安全性の確保等に関する
法律第 68 条により、一律に禁止されている
が、製薬企業等が行う治験に係る情報の提供
については、jRCT(Japan Registry of
Clinical Trials:臨床研究等提出・公開シス a:令和7年度検
テム)に登録・掲載されている範囲内である 討・結論・措置
限りにおいて、「治験に係る情報提供の取扱 b:令和7年度中
いについて」
(令和5年1月 24 日厚生労働省 を目途に措置
治験に係る広告規制の見
医薬・生活衛生局監視指導・麻薬対策課長通 c:令和7年度上
直し
知。以下「課長通知」という。
)により、
「治 期検討開始、令和
験に係る情報を求める者のみに対して情報 8年上期結論、結
提供」を行う場合には「広告」には該当しな 論を得次第速やか
いこととされており、製薬企業等は患者等に に措置
対して治験に係る情報の提供を行い、被験者
募集等を行っている。
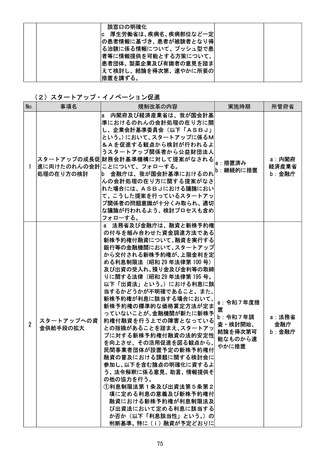
一方で、
・
「治験に係る情報を求める者」の該当性につ
いて具体的な基準等が示されていないこ
とから、製薬企業等は広告規制に抵触する
ことを避けるため過度に情報発信を控え
73
厚生労働省