『規制改革実施計画』 (33 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/publication/p_plan.html |
| 出典情報 | 規制改革実施計画(6/13)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
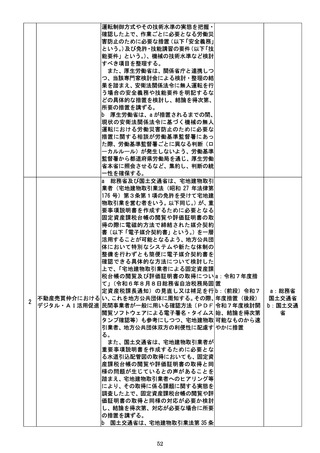
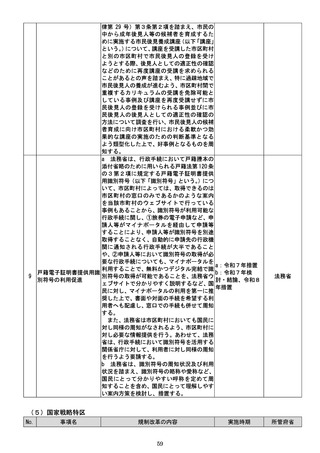
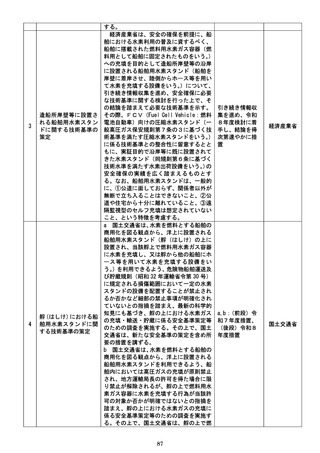
f 厚生労働省は、定期的な再検討が行われ
ずに要指導医薬品に継続的に指定されるこ
とがないよう、要指導医薬品に指定し続ける
要指導医薬品について、定期的に、適切なデ
ータを収集し、販売区分の変更に当たっての
課題整理を行った上で、指定を継続すること
の要否を改めて検討し、結論を得て、必要に
応じ、販売区分の変更を行う仕組みを設ける
ことについて検討し、結論を得次第、速やか
に所要の措置を講ずる。
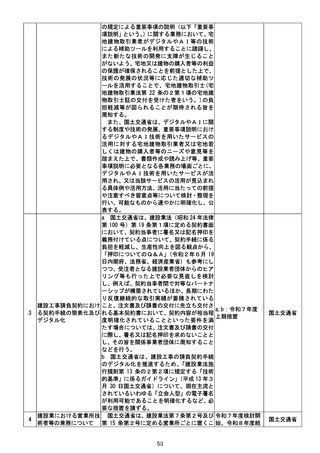
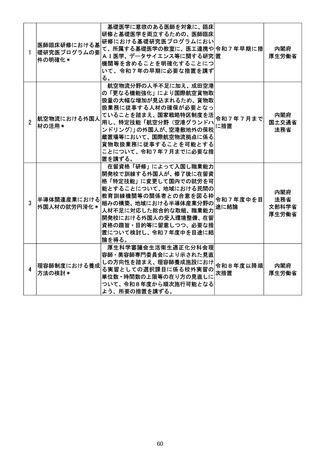
g 厚生労働省は、薬剤師の面前で直ちに服
薬する必要がある要指導医薬品のほか、厚生
労働省が要指導医薬品に指定し続ける要指
導医薬品を新たに設ける場合には、その判断
時に具体的な理由を明らかにし、公表すると
ともに、当該要指導医薬品に対する判断を他
の要指導医薬品に共通して合理的に適用可
能となる基準の作成についてその可否を含
め検討を行い、当該判断を最初に行った日か
ら2年以内に結論を得る。
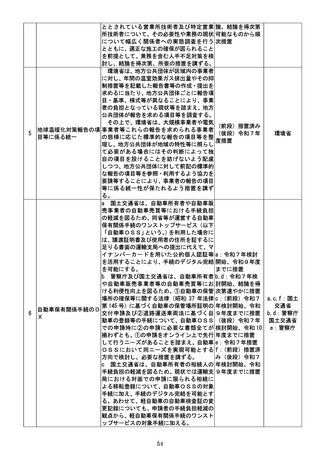
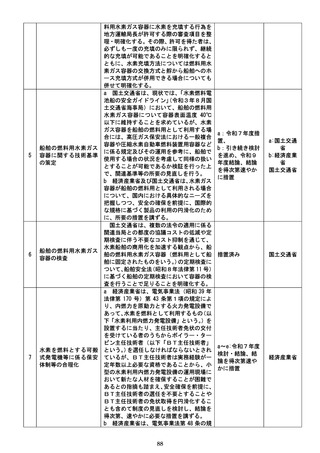
h 厚生労働省は、消費者の安全確保及び医
薬品へのアクセスの円滑化の観点から、個別
の一般用医薬品について、製造販売後調査そ
の他の客観的なデータ等に基づき、随時、適
切なリスク評価を行い、その結果に基づき、
販売区分の変更(一般用医薬品から要指導医
薬品への区分変更を含む。以下同じ。)を可能
とする新たな仕組みを設けることについて、
検討し、結論を得る。
その上で、厚生労働省は、当該結論を踏ま
え、所要の措置を講ずる。
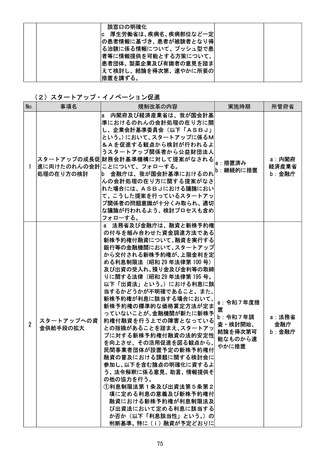
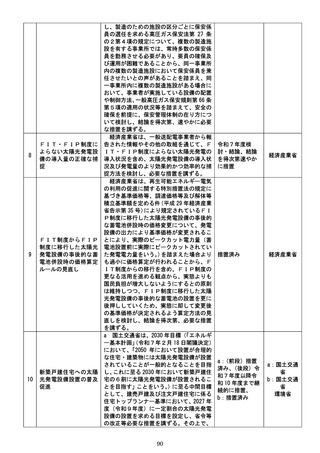
i 厚生労働省は、第一類医薬品(第二類医薬
品又は第三類医薬品から第一類医薬品に区
分変更されたものを含む。
)について、定期的
な再検討が行われずに第一類医薬品に継続
的に指定されることがないよう、第一類医薬
品への区分指定時から定期的に販売区分の
変更の要否を改めて検討し、結論を得て、必
要に応じ、販売区分の変更を行う等の仕組み
を設けることについて検討し、結論を得次
第、速やかに所要の措置を講ずる。
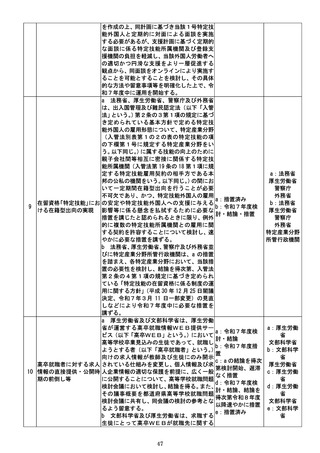
医薬品、医療機器等の品質、有効性及び安
全性の確保等に関する法律(以下「医薬品医
療機器等法」という。)に基づく医薬品等の承
認審査は、製造販売業者からの承認申請によ
り行われるが、厚生労働省において、一般用
a,b:厚生労
検査薬(一般用医薬品たる体外診断用医薬品 a,c:令和7年度措
働省
一般用検査薬への転用の をいう。以下同じ。)については、医療用検査 置
c:厚生労働
促進
薬(主に医療従事者が使用することを想定し b : 令 和 8 年 度 検
省
た医療用医薬品たる体外診断用医薬品をい 討・結論・措置
消費者庁
う。
)と異なり、一般の生活者が正しく使用で
きるよう、検査項目ごとに使用上の注意、使
用方法や性能等に関して承認審査のための
一定の基準を示しておくことが必要である
と考えられ、一般用検査薬への転用の基準と
29