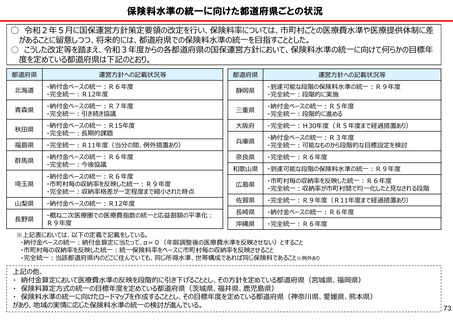
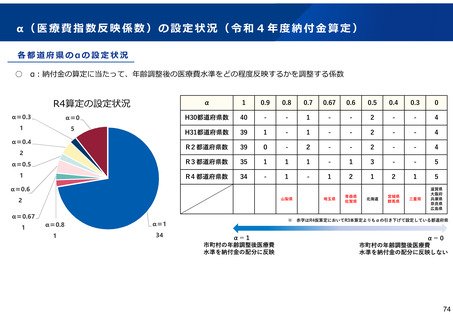
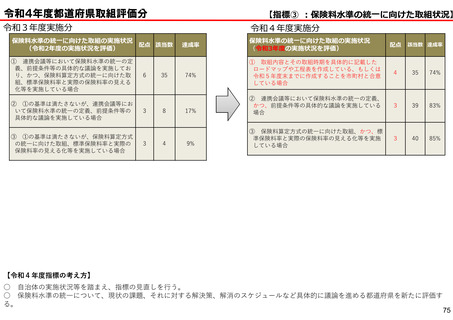
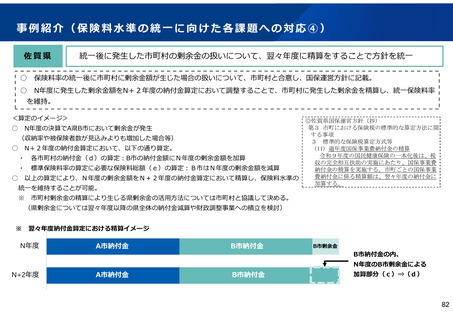
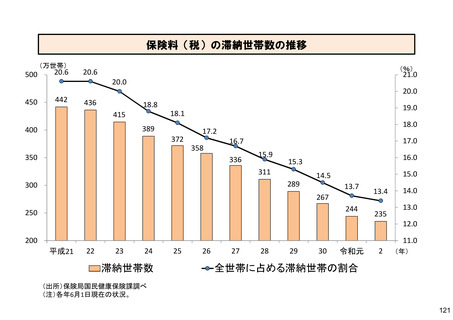
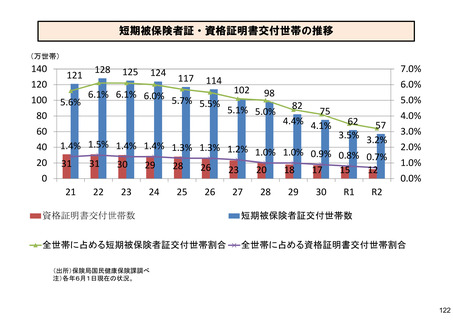
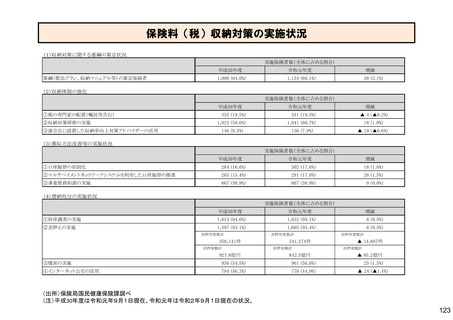
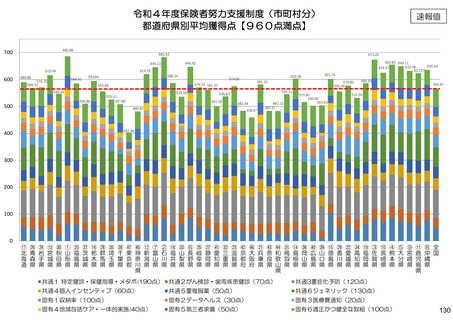
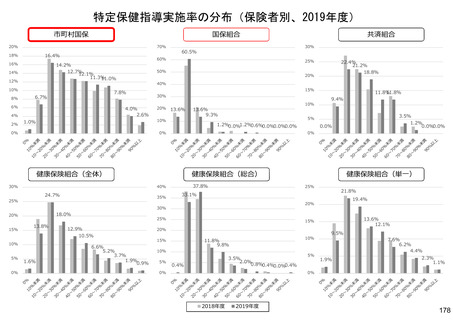
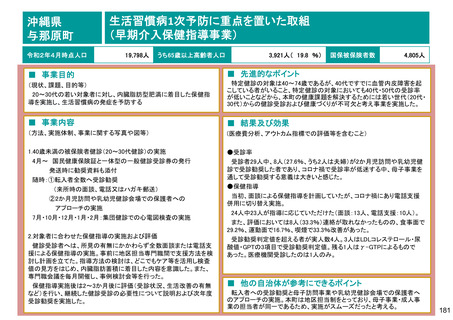
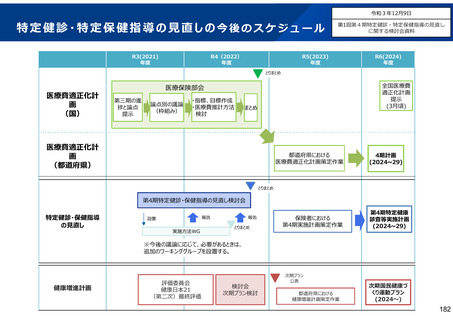
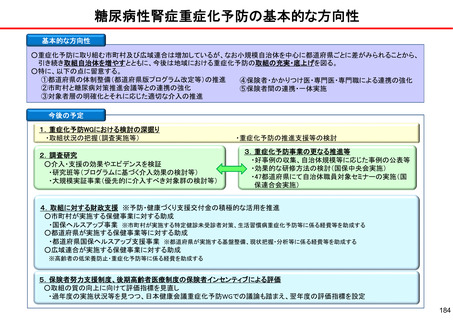
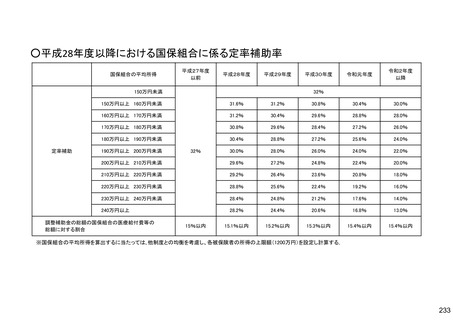
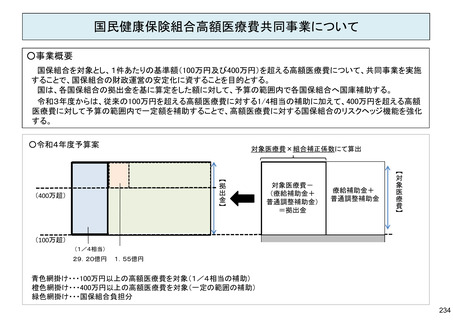
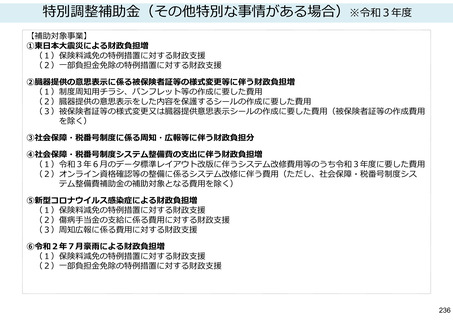
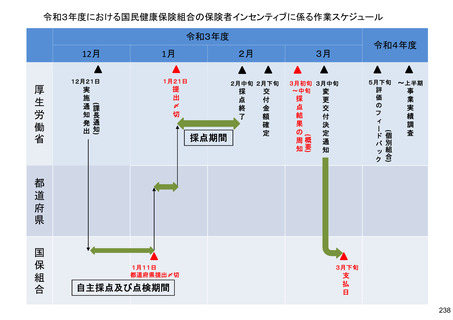
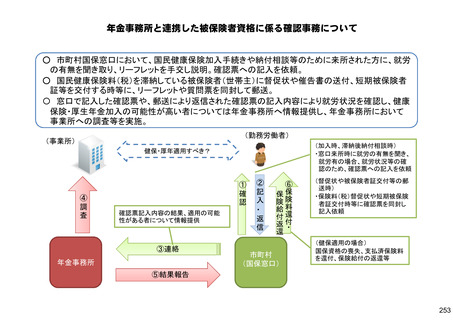
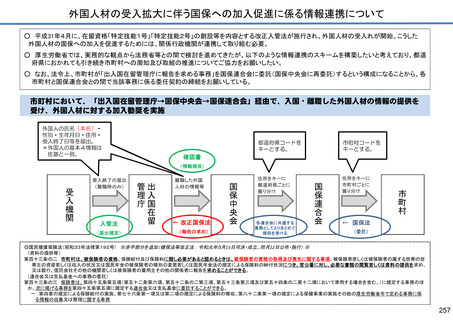
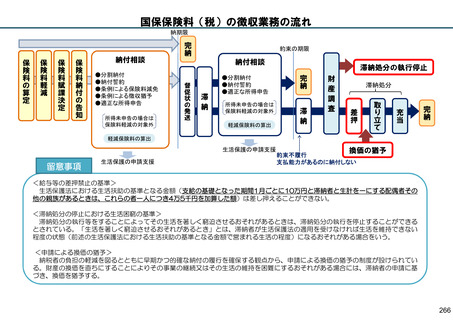
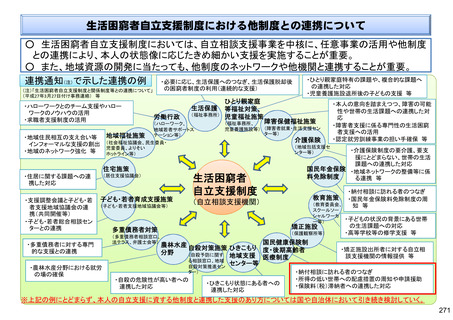
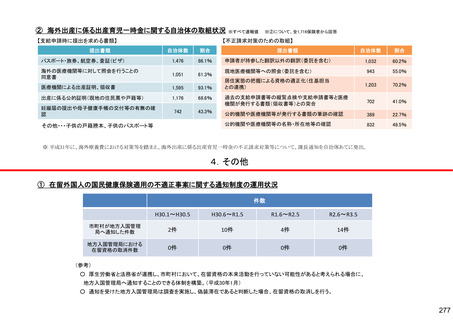
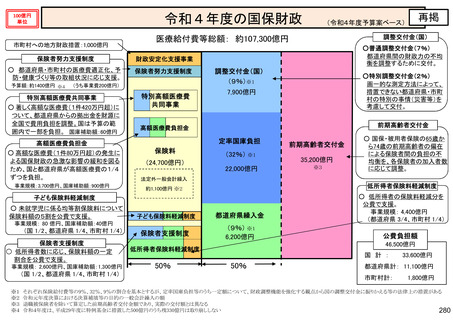
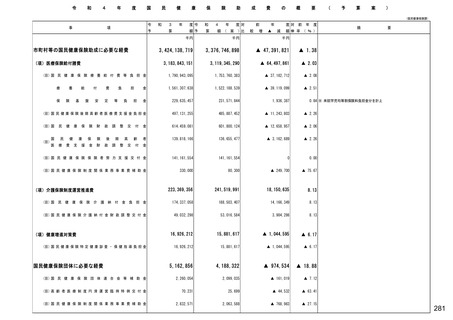
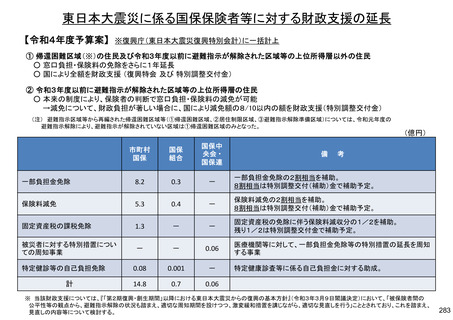
保険局国民健康保険課説明資料 (209 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24135.html |
| 出典情報 | 全国高齢者医療主管課(部)長及び国民健康保険主管課(部)長並びに後期高齢者医療広域連合事務局長会議(2022年3月2日開催 3/2)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
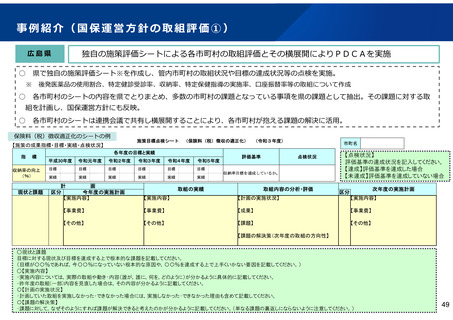
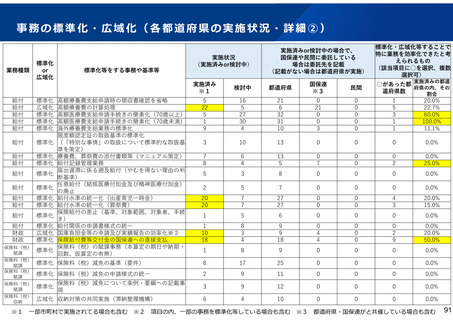
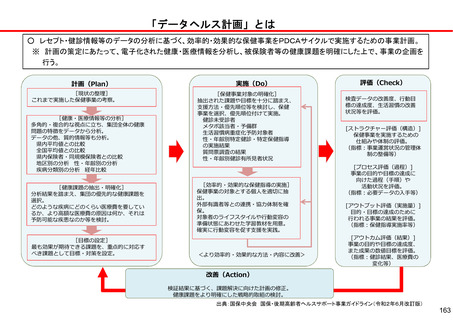
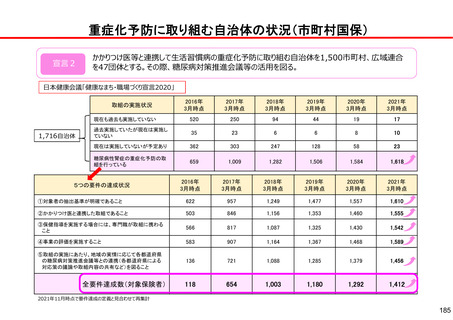
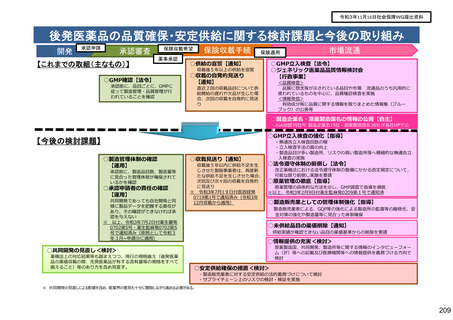
後発医薬品の品質確保・安定供給に関する検討課題と今後の取り組み
開発
承認申請
承認審査
【これまでの取組(主なもの)】
保険収載手続
保険収載希望
薬事承認
○GMP確認【法令】
承認前に、品目ごとに、GMPに
従って製造管理・品質管理が行
われていることを確認
保険適用
○供給の宣誓【通知】
市場流通
○GMP立入検査【法令】
○ジェネリック医薬品品質情報検討会
【行政事業】
収載後5年以上の供給を宣誓
○収載の自発的見送り
【通知】
<品質検査>
品質に懸念等が示されている品目や市場 流通品のうち汎用的に
使われているものを中心に、品質確認検査を実施
<情報発信>
有効成分毎に品質に関する情報を取りまとめた情報集(ブルー
ブック)の公表等
直近2回の収載品目について供
給開始の遅れや欠品が生じた場
合、次回の収載を自発的に見送
り
○製造企業名・原薬製造国名の情報の公開【自主】
・JGA加盟39社中 製造企業名19社・原薬製造国名36社が各社HPで公
表
○GMP立入検査の強化【指導】
【今後の検討課題】
○製造管理体制の確認
【運用】
承認前に、製造品目数、製造量等
に見合った管理体制が確保されて
いるかを確認
○承認申請者の責任の確認
【運用】
共同開発であっても自社開発と同
様に製品データを把握する責任が
あり、その確認ができなければ承
認を与えない
※ 以上、令和3年7月2日付薬生審発
0702第5号・薬生監麻発0702第5
号で通知済み(原則として令和3
年3月~申請分に適用)
○収載見送り【通知】
収載後5年以内に供給不足を生
じさせた製販事業者は、再度新
たな供給不足を生じさせた場合、
次回及び次々回の収載を自発的
に見送り
※ 令和3年7月19日付医政経発
0719第1号で通知済み(令和3年
12月収載から適用)
・無通告立入検査回数の増
・立入検査手法の質の向上
・製造品目が多い製造所、リスクの高い製造所等へ積極的な無通告立
入検査の実施
○法令遵守体制の前倒し【法令】
改正薬機法における法令遵守体制の整備にかかる改定規定について、
可能な限り前倒し実施を要請
○原薬管理の徹底【指導】
原薬管理の具体的な方法を示し、GMP調査で指導を徹底
※以上、令和3年2月9日付薬生監麻発0209第1号で通知済
○製造販売業としての管理体制強化【指導】
製造販売業者による、GQP等の強化による製造所の監督等の厳格化、安
全対策の強化や製造量等に見合った体制確保
○未供給品目の薬価削除【通知】
供給実績が確認できない品目の薬価基準からの削除を要請
○情報提供の充実<検討>
原薬製造国、共同開発、製造所等に関する情報のインタビューフォー
ム(IF)等への記載及び医療機関等への情報提供を義務づける方向で
検討
○共同開発の見直し<検討>
薬機法上の対応結果等も踏まえつつ、現行の規格揃え(後発医薬
品の薬価収載の際、先発医薬品が有する含有量等の規格をすべて
揃えること)等のあり方を含め見直す。
○安定供給確保の措置<検討>
・製造販売業者に対する安定供給の法的義務づけについて検討
・サプライチェーン上のリスクの検討・検証を実施
※ 共同開発の見直しによる影響を含め、産業界の意見も十分に聴取しながら進める必要がある。
209