資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過)[1.9MB] (353 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_39491.html |
| 出典情報 | 予防接種・ワクチン分科会副反応検討部会(第101回 4/15)医薬品等安全対策部会安全対策調査会(令和6年度第1回 4/15)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
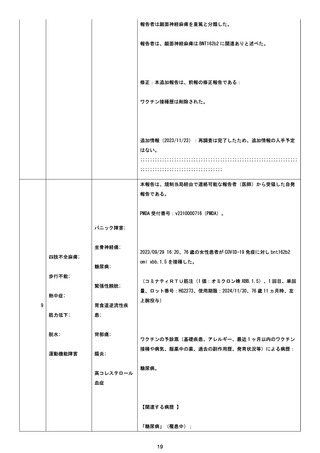
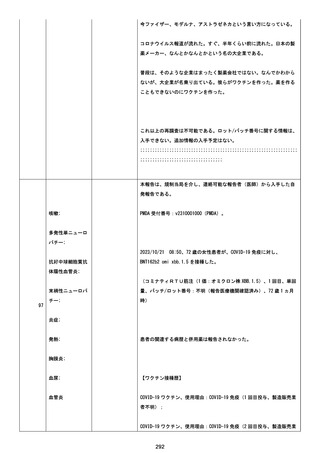
た。
追加情報(2023/12/20):本報告は、医薬品医療機器総合機構(PMDA)
を介し追跡調査の返信により同じ薬剤師から入手した自発追加報告であ
る。
PMDA 受付番号、v2310001131。
更新情報:再調査可否を「はい」に更新;報告者#1 情報更新;ワクチン接
種時患者年齢追加;患者イニシャルを「unknown」から「PRIVACY」に更
新;被疑薬開始時刻、ロット番号および使用期限追加;ワクチン歴追加;併
用ワクチン追加;臨床検査値データ追加。新たな事象顔面神経麻痺追加、
症例を重篤にアップグレード。
再調査は完了したため、追加情報の入手予定はない。
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;
353